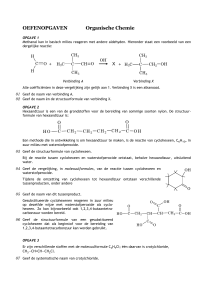
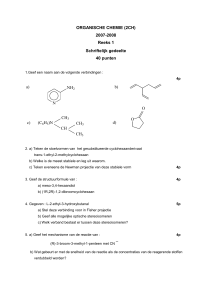
OWCH3BW 001-008.indd
advertisement

Copyright Plantyn Chemie is overal 5 OWCH3BW 001-008.indd 5 17/06/14 8:26 PM Dieper inzicht verwerven in chemie documenteren – onderzoeken - rapporteren – evalueren - toepassen Copyright Plantyn In de tweede graad van het secundair onderwijs heb je via de handboeken Op weg met chemie 1 en 2 al een belangrijke basiskennis van chemie verworven. Je leerde over zuivere stoffen en mengsels, over enkelvoudige en samengestelde stoffen. Je maakte kennis met de rol van atomen en atoomsoorten (chemische elementen) in de samenstelling en met eigenschappen van stoffen. Door inzicht in de bouw van atomen en de rol van hun elektronen bij interactie met andere atomen, begrijp je beter de vorming van moleculen en hun verband met stofeigenschappen. Je leerde chemische reacties begrijpen als processen waarbij atomen van de reagensmoleculen worden herschikt, maar waarbij geen atoomsoorten of atomen verdwijnen. Chemische reacties gaan wel steeds gepaard met een energieuitwisseling in hun omgeving. Chemische reacties liggen aan de basis van talrijke verschijnselen in de natuur en in jouw onmiddellijke leefomgeving. Hoewel hun waarneembaar verloop dikwijls zeer verschillend is, kunnen veel chemische processen toch worden herleid tot enkele eenvoudige reactiemechanismen. Je herinnert je allicht nog synthese-, ontleding- en substitutiereacties, reacties tussen ionen in water met neerslag- of gasvorming, reacties tussen zuren en basen, reacties met elektronenoverdracht tussen de aanwezige deeltjes, zoals verbrandingen en andere oxidatiereductiereacties. Je leerde ook reeds dat bij chemische reacties moleculen en stoffen met elkaar in interactie treden in welbepaalde en constante hoeveelheden. Let op: met ‘stofhoeveelheid’ in de chemie wordt niet de massa of het volume bedoeld maar wel een aantal stofdeeltjes, uitgedrukt in ‘mol’. Met die basiskennis kun je nu verder op weg naar meer diepgang van je chemische kennis. Je vindt in Op weg met chemie 3B vooreerst meer informatie over de soorten anorganische en organische stofklassen en hun karakteristieke atoomgroepen (Hfst. 1). Je leert ook dat elektronen, volgens de bevindingen van de moderne atoomfysica, eigenlijk moeten worden beschouwd als elektrische ladingswolken en dat hun vorm en ruimtelijke positie binnen de atomen en moleculen in sterke mate de ruimtelijke structuur en eigenschappen van moleculen en stoffen mee bepalen (Hfst. 2 en 3). Chemische reacties verlopen volgens de wet van massabehoud en volgens constante molverhoudingen. Je leert dat dit ook in overeenstemming is met de waargenomen volumeveranderingen bij gasreacties. Bovendien zul je kennismaken met een ‘limiterend reagens’ of een ‘reagens in overmaat’, die aantonen dat reagentia wel degelijk in bepaalde verhoudingen met elkaar reageren. Het model van de chemische reactie dat je zo leert hanteren, wordt wel wat ingewikkelder, maar dat levert de noodzakelijke basisinzichten die je nodig zult hebben voor de studie van vaak voorkomende dynamische chemische evenwichten (2de jaar van de derde graad). Je zult de natuur en ook je eigen lichaam leren bekijken als één groot evenwichtssysteem tussen stoffen. Meteen zul je ook een meer gefundeerd en kritisch ecologisch en gezondheidsbewustzijn kunnen verwerven ten aanzien van gevaarlijke storende invloeden op de stoffensystemen in onze aarde en haar atmosfeer. 6 OWCH3BW 001-008.indd 6 17/06/14 8:26 PM Al die informatie vind je in Op weg met chemie 3B zoals voorgeschreven wordt door het leerprogramma voor chemie in het eerste jaar van de derde graad. Onder begeleiding van je leerkracht zul je die kennis vervolgens verwerken en verdiepen, ondermeer door het uitvoeren van een aantal experimenten in het schoollabo en zul je ervaring opdoen in het opzoeken van interessante aanvullende documentatie. Je bevindingen daarbij zul je leren rapporteren en kritisch evalueren om juiste en belangrijke besluiten te kunnen trekken en die voorgoed in jouw wetenschappelijke bagage op te slaan. Je chemische kennis en inzichten moet je ook leren toepassen en gebruiken in andere vakgebieden, zoals biologie, fysica, geografie, geologie, technologie … Zo zul je de chemie ontdekken in je alledaagse leefmilieu en haar rol in de maatschappij ervaren, d.w.z. zowel de positieve als negatieve aspecten ervan kritisch leren beoordelen. We wensen je veel succes op je verdere weg naar dieper inzicht in chemie! Copyright Plantyn De auteurs 7 OWCH3BW 001-008.indd 7 17/06/14 8:26 PM Copyright Plantyn OWCH3BW 001-008.indd 8 17/06/14 8:26 PM Copyright Plantyn 1. VERDERE KENNISMAKING MET STOFKLASSEN Verdere kennismaking met stofklassen Hoofdstuk 1 9 OWCH3BW 009-070.indd 9 17/06/14 8:03 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN 1 Verdere kennismaking met stofklassen Denk er eens over na Copyright Plantyn 1 4 6 • • • • 2 Veelvoud aan stoffen 5 Sterrennevel Racefiets 7 3 Speelgoed uit ... Koffieservies Voedingsindustrie Autodesign 8 Angorawol Welke soorten stoffen vind je terug op de bovenstaande foto’s? Rangschik de soorten stoffen in twee groepen: anorganische en organische. Welke criteria gebruik je daarvoor? Elke groep wordt nog verder ingedeeld in stofklassen. Noem een aantal stofklassen die je al kent. Welk criterium gebruik je om stoffen in een bepaalde stofklasse onder te brengen? 10 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 10 17/06/14 8:03 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN • Op welke foto zie je een composiet (een organische stof op een anorganische drager)? Hoe merk je dat? • Komen in het heelal ook anorganische en organische stoffen voor? • Wat betekent de naam kunststoffen voor jou? • Zijn producten afkomstig van de chemische industrie voor jou altijd synthetische stoffen? • Kun je door louter observatie weten of wol gekleurd is met natuurstoffen of met synthetische stoffen? Copyright Plantyn Leer de chemie Stoffen worden ingedeeld in minerale of anorganische stoffen en in koolstofverbindingen of organische stoffen. Minerale stoffen tref je aan in de lithosfeer (bodem, gesteenten, ertsen ...), in de hydrosfeer (opgeloste stoffen in water) en in de atmosfeer (lucht). Organische stoffen komen vooral voor in planten en dieren of stoffen die daarvan afkomstig zijn. Anorganische, maar vooral organische stoffen, kunnen ook in het laboratorium worden bereid: niet alleen die welke in de natuur voorkomen, maar ook vele andere (bv. kunststoffen, geneesmiddelen ...). Zowel anorganische als organische stoffen worden verder ingedeeld in stofklassen. Stoffen die behoren tot eenzelfde stofklasse zijn meestal herkenbaar door een bepaalde karakteristieke of functionele groep in hun moleculen en hebben gemeenschappelijke chemische eigenschappen. Opmerking Bij de naamvorming van zuivere stoffen zul je voortaan niet alleen aandacht schenken aan de aspecten juistheid en eenduidigheid, maar ook aan het gebruik van eenvoudige stofnamen. Dat betekent onder andere dat in de systematische naam van minerale stoffen soms indices weggelaten kunnen worden, zonder de juistheid en eenduidigheid te schaden. Dat geldt voor verbindingen waarvan de atomen of atoomgroepen vaste oxidatiegetallen hebben. Voor elementen met meerdere mogelijke oxidatiegetallen verschillend van nul, moet je dubbelzinnigheid in de naam vermijden door de indices of het oxidatiegetal te vermelden. Naarmate de moleculen een meer ingewikkelde structuur vertonen, wordt de systematische naam ook ingewikkelder. Daarom wordt in de gesproken en niet-gespecialiseerde chemische vaktaal de voorkeur gegeven aan eenvoudiger gebruiksnamen (triviaalnamen). Die namen leveren uiteraard wel minder informatie over de eigenlijke structuur van de moleculen waaruit de stoffen zijn opgebouwd. 1 Verdere kennismaking met stofklassen | 11 OWCH3BW 009-070.indd 11 17/06/14 8:03 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN 1.1 Stofklassen van de anorganische of minerale chemie Copyright Plantyn 1 Anorganische oxiden worden gebruikt als kleurpigment. 4 Zoutmijn. Is er een verschil met zeezout? 2 Kaliumfosfaat en -nitraat komen veel voor in meststoffen. 6 Het ontzwavelen van rookgas- 7 sen levert veel gips (CaSO4 ). 5 De glasindustrie gebruikt veel SiO2 en Na2CO3. 3 Sedimentlagen ontstaan door neerslagvorming. Zand is hoofdzakelijk SiO2. 8 In een drogisterij vind je veel anorganische stoffen voor thuisgebruik. 1.1.1 Oxiden • Definities - karakteristieke groep Zowel metalen als niet-metalen vormen met zuurstof binaire verbindingen, die men oxiden noemt. De karakteristieke groep is O. • Indeling van de oxiden – Metaaloxiden zijn ionverbindingen van metaalionen (M n ) met oxide-ionen (O 2 ). De aanwezigheid van oxide-ionen is karakteristiek voor deze verbindingen. – Niet-metaaloxiden zijn atoomverbindingen van niet-metalen en zuurstof. Eén of meerdere covalent gebonden zuurstofatomen zijn karakteristiek voor deze verbindingen. Van de meeste niet-metaalatomen komen meerdere niet-metaaloxiden voor. 12 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 12 17/06/14 8:03 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN • Formule- en naamvorming Metaaloxiden Algemene formule MnOm De indices (n en m) of de aantalverhouding tussen de metaalionen en de O2-ionen kun je gemakkelijk vinden als je de waarde van het oxidatiegetal (of de ionlading) van het metaalion kent. Naamvorming (n) naam van het metaal (m) oxide De (Griekse) telwoorden hoef je niet noodzakelijk in de naam te vermelden, tenzij bij metalen die meerdere oxidatiegetallen kunnen aannemen. Je kunt ook het oxidatiegetal in de naam opnemen (Stocknotatie). Copyright Plantyn Voorbeelden Ag2O dizilveroxide zilveroxide FeO ijzeroxide ijzer(II)oxide Fe2O3 di-ijzertrioxide ijzer(III)oxide Niet-metaaloxiden Algemene formule Naamvorming (nM)nOm (n) naam van het niet-metaal (m) oxide De indices (n en m) of het oxidatiegetal van het niet-metaal worden (in principe) wel vermeld om een onderscheid te maken tussen de verschillende oxiden die van elk niet-metaal gekend zijn. Voorbeelden SO2 zwaveldioxide zwavel(IV)oxide N2O distikstofmonoxide (lachgas) stikstof(I)oxide SO3 zwaveltrioxide zwavel(VI)oxide NO stikstofmonoxide stikstof(II)oxide CO koolstofmonoxide koolstof(II)oxide N2O3 distikstoftrioxide stikstof(III)oxide CO2 koolstofdioxide (koolzuurgas) koolstof(IV)oxide NO2 • stikstofdioxide N2O5 distikstofpentaoxide stikstof(IV)oxide stikstof(V)oxide Eigenschappen van de oxiden Metaaloxiden • Deze stoffen zijn ionverbindingen: kristallijne vaste stoffen met meestal een hoog smeltpunt. • De oplosbaarheid in water wordt vooral bepaald door de lading en de straal van het metaalion. Hoe groter de lading en hoe kleiner de straal, des te geringer de oplosbaarheid! Li2O, Na2O en K2O lossen goed op; CaO en Al2O3 daarentegen slecht. Het oplossen is geen zuiver fysisch oplosproces: er komen immers ionen vrij (dissociatieproces) en er treedt een reactie op tussen O2-ionen en H2O-moleculen. Daarbij ontstaan OH1-ionen. • Deze metaaloxiden noem je daarom basevormende oxiden. 1 Verdere kennismaking met stofklassen | 13 OWCH3BW 009-070.indd 13 17/06/14 8:03 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Voorbeeld water Na2O 2 Na1 O2 O2 H2O → 2 OH1 Totale reactie Na2O H2O → 2 Na1 2 OH1 Niet-metaaloxiden • Deze stoffen zijn (polaire of apolaire) atoomverbindingen. Er komen zowel gasvormige (CO, CO2, SO2), vloeibare (H2O) als vaste (P2O5, SiO2) oxiden voor. • Afhankelijk van hun dipoolkarakter lossen deze oxiden goed of minder goed op in water. • Oplosbare niet-metaaloxiden reageren met watermoleculen tot een ternair zuur (waarin het nM-atoom eenzelfde OG-waarde aanneemt). Deze oxiden noem je daarom zuurvormende oxiden. Voorbeelden CO2 H2O → H2CO3 (in spuitwater) SO3 H2O → H2SO4 1 Copyright Plantyn 2 3 4 5 6 basevormende oxiden H2O Zuur/basegedrag van de oxiden zuurvormende oxiden Li2O BeO B2O3 CO2 N2O5 Na2O MgO Al2O3 SiO2 P2O5 SO3 Cl2O7 K2O CaO Sc2O3 TiO2 V2O5 CrO3 Mn2O7 Fe2O3 Co2O3 NiO Cu2O ZnO Ga2O3 GeO2 As2O5 SeO3 (HBrO3) * Rb2O SrO Y2O3 ZrO2 Nb2O5 MoO3 Tc2O7 RuO2 Rh2O3 PdO Ag2O CdO In2O3 SnO2 Sb2O5 TeO3 (HI03) Cs2O BaO La2O3 HfO2 Ta2O5 WO3 Re2O7 OsO4 IrO2 PtO Au2O HgO Tl2O3 PbO Bi2O5 * PdO: geen reactie met water • Oxiden rondom ons In ons dagelijkse leven heb je regelmatig met oxiden te maken. • In verbrandingsgassen van fossiele brandstoffen (aardgas, benzine, stookolie, steenkool) komen o.a. SO2, CO2 en NxOy voor. Die oxiden zijn verantwoordelijk voor de zogenaamde zure regen. • Prikhoudende dranken bevatten CO2. • Levende wezens ademen CO 2-gas uit. Anderzijds wordt tijdens de fotosynthese CO 2-gas omgezet in glucose. • SO2-gas wordt als conserveermiddel in wijn en vruchtensappen gebruikt. • Fe2O3 ontstaat bij roestvorming. De gevormde bruine roest is zeer poreus zodat het ijzer steeds verder aangetast wordt. Bruiswater 14 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 14 17/06/14 8:03 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN • SiO2 is het basisbestanddeel van zand, glas en van een aantal halfedelstenen, zoals amethist en opaal (zie fig.) • Al2O3 vormt zich spontaan als een dun, ondoorlaatbaar laagje aan de buitenkant van het aluminium voorwerp en beschermt het metaal tegen verdere oxidatie. • CaO (bv. ongebluste kalk) komt voor in cement en plaaster. • Pb3O4 (loodmenie) is een mengsel van twee oxiden, maar met een vaste verhouding: 2PbO . PbO2. Het is zoals alle loodverbindingen een giftige stof en wordt vooral gebruikt als roestwerende laag. Opaal 1.1.2 Zuren • Definities - karakteristieke groep Arrhenius en Brønsted zijn de belangrijkste wetenschappers die zich hebben toegelegd op de studie van zuren en basen. Definities Copyright Plantyn Arrhenius (1887) Zuren zijn stoffen die in water ioniseren en daarbij H1 +-ionen vormen. Voorbeelden HCl H2SO4 water H1 Cl1 water 2 H1 SO2 4 Brønsted (1923) Zuren zijn stoffen die zich gedragen als protondonor (H1 +-afgifte). De afsplitsing van H1 hoeft niet noodzakelijk in waterige oplossing te gebeuren. Deze opvatting van een zuur is dus ruimer dan die van Arrhenius. Voorbeelden HCl (zuur) HCl(g) (zuur) H2O (base) → H3O1 Cl1 NH3(g) (base) → NH1 4 Cl1 (NH4Cl) (zout) Karakteristieke groep Zowel de Arrhenius- als de Brønsted-definitie van een zuur is gebaseerd op de afsplitsing van H1ionen en de vorming van een negatief zuurrest-ion. De karakteristieke groep in een zuurmolecule is een gepolariseerde H-(nM)-binding waaruit een H1-ion kan worden vrijgemaakt. Voorbeelden δ+ δ- H Cl δ+ δ- H2SO4 ⇔ H O HCl ⇔ 11+ H + Cl O S δ- δ+ O H 21+ 2 H + SO 4 O 1 Verdere kennismaking met stofklassen | 15 OWCH3BW 009-070.indd 15 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN • Indeling van de zuren Copyright Plantyn Om de zuren in te delen gebruik je verschillende criteria, zoals samenstelling, waardigheid en zuursterkte. • Op basis van de samenstelling onderscheid je: – binaire zuren: de molecule is opgebouwd uit atomen van slechts twee elementen (H en nM), bv. H2S – ternaire zuren (oxozuren): de molecule is opgebouwd uit atomen van drie elementen (H, O en nM), bv. H2SO4 • Op basis van de waardigheid (verwijst naar het maximumaantal H1-deeltjes die uit één zuurdeeltje afgesplitst kunnen worden) onderscheid je: – eenwaardige zuren, bv. HCl – tweewaardige zuren, bv. H2SO4 – driewaardige zuren, bv. H3PO4 • Op basis van de zuursterkte (verwijst naar het al of niet makkelijk afsplitsen van H1) onderscheid je: – sterke zuren, bv. HCl, H2SO4 – zwakke zuren, bv. HNO2, H2S • Formule- en naamvorming Algemene formule HnZ (Z zuurrest) Hn(nM) binair zuur Hn(nM)Op ternair zuur Molecuulmodellen van onderstaande voorbeelden Het oxidatiegetal van de waterstofatomen in zuren is I. Je kunt de formule makkelijk opstellen als het (totale) oxidatiegetal van de zuurrest (Z) gekend is. Voorbeeld Z (zuurrest) OG (zuurrest) Formule (HnZ) OG (overige atomen) F -I HF S -II H2S CO3 -II H2CO3 OG (C) IV, OG(O) -II PO3 -III H3PO3 P kan voorkomen met verschillende oxidatiegetallen. Hier is het OG (P) III. CN -I HCN HCN is een pseudobinair zuur. Het cyanide-ion (CN1) is te vergelijken met een halogenide-ion (bv. Cl1). Naamvorming (n) - waterstof naam van de zuurrest (Z) Dit (Griekse) telwoord hoef je niet noodzakelijk in de naam te vermelden. binair zuur: nMide ternair zuur: nMaat (iet, per...aat, hypo...iet) 16 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 16 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Voorbeelden HCl waterstofchloride H2SO4 (di)waterstofsulfaat H2S (di)waterstofsulfide HCN waterstofcyanide Opmerkingen • De naam van het ternair zuur heeft de uitgang aat wanneer het centrale nM-atoom het hoogst positieve oxidatiegetal aanneemt. Een uitzondering daarop vormen de oxozuren van de halogenen (groep VII). • In de formule van de aat-zuren van N (HNO3), C (H2CO3) en B (H3BO3) komen slechts drie O-atomen voor in plaats van vier zoals in H2SO4, H3PO4 en H4SiO4. Deze nM-atomen van de tweede periode in het P.S.E. zijn zo klein dat er ruimtelijk onvoldoende plaats is voor de schikking van vier O-atomen. • Naast de systematische naam benoemt men zuren ook met triviale namen, bv. zoutzuur voor HCl, blauwzuur voor HCN. Overzicht zuren Copyright Plantyn nM Groep OG PSE (nM) Zuurrest (Z) Formule zuur Naam van het zuur Samenstelling OG (Z) HnZ systematisch triviaal zoutzuur Binaire zuren Cl VIIa -I Cl1 -I HCl waterstofchloride I VIIa -I I1 -I HI waterstofjodide S VIa -II S2 -II H2S waterstofsulfide zwavelwaterstof CN -- -I CN1 -I HCN waterstofcyanide blauwzuur VII ClO1 4 -I HClO4 waterstofperchloraat perchloorzuur V ClO1 3 -I HClO3 waterstofchloraat chloorzuur III ClO1 2 -I HClO2 waterstofchloriet chlorigzuur I ClO1 -I HClO waterstofhypochloriet hypochlorigzuur VI SO2 4 -II H2SO4 (di)waterstofsulfaat zwavelzuur IV SO2 3 -II H2SO3 (di)waterstofsulfiet zwaveligzuur V NO1 3 -I HNO3 waterstofnitraat salpeterzuur III NO1 2 -I HNO2 waterstofnitriet salpeterigzuur V PO3 4 -III H3PO4 (tri)waterstoffosfaat fosforzuur III PO3 3 -III H3PO3 (tri)waterstoffosfiet fosforigzuur Ternaire zuren Cl of (Br) VIIa (I) S N VIa Va P of (As) Va C IVa IV CO2 3 -II H2CO3 (di)waterstofcarbonaat koolzuur Si IVa IV SiO4 4 -IV H4SiO4 (tetra)waterstofsilicaat kiezelzuur B IIIa III BO3 3 -III H3BO3 (tri)waterstofboraat boorzuur 1 Verdere kennismaking met stofklassen | 17 OWCH3BW 009-070.indd 17 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN • Eigenschappen van zuren • Zuren zijn covalente verbindingen met dipoolmoleculen. Bij HF en de ternaire zuren kunnen waterstofbruggen tussen de moleculen voorkomen. • Binaire zuren zijn gasvormig (bv. HCl, H2S). Ternaire zuren zijn vloeibaar (bv. H2SO4, HNO3) of vast (bv. H3BO3, HIO4). • De meeste minerale zuren lossen op in water. Deze oplossingen hebben een zure smaak. In water ioniseren de zuren en vormen onder andere H3O1-ionen (zie definities). Copyright Plantyn • Zuren rondom ons Wij hebben met heel wat toepassingen van zuren te maken. • HCl of zoutzuur komt voor in het maagsap voor de vertering van voedsel. Het wordt ook gebruikt om kalk en cement te verwijderen. • H2S ontstaat bij de afbraak van S-houdende verbindingen. Het komt voor in darmgas, in de buurt van vulkanen en ook in eieren. • H3BO3 wordt gebruikt als ontsmettingsmiddel voor de ogen. • HNO3 en H3PO4 zijn grondstoffen voor de synthese van meststoffen. • H2SO4 wordt ook accuzuur genoemd omdat het als elektrolyt voorkomt in elke loodaccumulator (auto). • HCN (blauwzuur) is een zeer giftige stof. Het komt in kleine hoeveelheden voor in pitten van bv. amandelen. Tijdens de Tweede Wereldoorlog werd het door de nazi's gebruikt in de uitroeiingskampen, o.a. in Auschwitz. • H3PO4 wordt ook aangetroffen in coladranken. • H2CO3 is in oplossing aanwezig in prikhoudende frisdranken. Naast die anorganische zuren komen tal van organische zuren voor in voeding en in het milieu. 1.1.3 Basen • Definities - karakteristieke groep Definities Arrhenius (1887) Basen zijn stoffen die in water dissociëren in ionen: er worden altijd hydroxide-ionen (OH1ⴚ) vrijgezet. Voorbeelden water NaOH Ba(OH)2 water Na1 OH1 Ba2 2 OH1 Brønsted (1923) Basen zijn stoffen waarvan de deeltjes zich gedragen als protonacceptor (H1ⴙ-opname). Het oplosmiddel speelt daarbij, in tegenstelling tot de theorie van Arrhenius, geen essentiële rol. 18 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 18 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Voorbeelden OH1ⴚ H1 → H2O (base) NaOH (opl) HCl(opl) → H2O (Na1Cl1)(opl) NH3 (g) HCl(g) → (NH14 Cl1)(v) Karakteristieke groep Volgens de Arrhenius-definitie is het OH1ⴚ-ion, vrijgekomen bij de dissociatie van de base in water, typisch voor een base en dus de karakteristieke groep. Karakteristiek voor een Brønsted-base is dat in de molecule ten minste één vrij elektronenpaar voorkomt om een proton (H1) te binden. Alleen in waterig midden vormt de Brønsted-base OH1ⴚ-ionen. Copyright Plantyn • Indeling van de basen Je kunt de basen volgens dezelfde criteria als de zuren indelen, namelijk volgens samenstelling, waardigheid en sterkte. • Op basis van de samenstelling onderscheid je: – hydroxidebasen, bv. NaOH, Ca(OH)2 – stikstofbasen, bv. NH3, NH2-NH2. • Op basis van de waardigheid (verwijst naar het maximumaantal OH1-ionen die van één basemolecule afgesplitst kunnen worden) onderscheid je: – eenwaardige basen, bv. NaOH – tweewaardige basen, bv. Ca(OH)2 – driewaardige basen, bv. Al(OH)3. • Op basis van de sterkte (verwijst naar de mate waarin ionen vrijkomen) onderscheid je: – sterke basen, bv. NaOH – zwakke basen, bv. NH3. • Formule- en naamvorming (hydroxidebasen) Algemene formule Naamvorming M(OH)n metaal (n) hydroxide Sommige metalen vertonen meerdere oxidatiegetallen. In die verbindingen moet je het oxidatiegetal of de nodige indices in de naam vermelden. Als het metaal een vast oxidatiegetal heeft, kun je slechts één correcte formule schrijven. Het totale oxidatiegetal van de OH1-groep is immers -I. De indices worden hier meestal niet meer vermeld. 1 Verdere kennismaking met stofklassen | 19 OWCH3BW 009-070.indd 19 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Voorbeelden NaOH natriumhydroxide Cu(OH)2 koperdihydroxide koper(II)hydroxide KOH kaliumhydroxide CuOH koperhydroxide koper(I)hydroxide Ca(OH)2 calciumdihydroxide calciumhydroxide AgOH zilverhydroxide Ba(OH)2 bariumdihydroxide bariumhydroxide Copyright Plantyn • Eigenschappen van de (hydroxide)basen • Hydroxiden zijn ionverbindingen en dus vaste stoffen. • Hydroxiden van de metalen van – groep Ia (in het P.S.E.) zijn goed oplosbaar in water (bv. LiOH, NaOH, KOH). – groep IIa zijn minder goed oplosbaar (bv. Ba(OH)2, Ca(OH)2). • De overige hydroxiden zijn nagenoeg onoplosbaar in water (bv. Al(OH)3, Pb(OH)2, Cu(OH)2). • Bij het oplossen in water dissocieert het hydroxide en reageert basisch. • Enkele gekleurde hydroxiden: Cu(OH)2, Fe(OH)3, Mn(OH)2 Basen rondom ons Ook basen zijn nuttig voor allerlei toepassingen. • Vast NaOH, beter bekend als bijtende soda, wordt gebruikt als ontstoppingsmiddel voor sanitaire leidingen. • NaOH en KOH worden aangewend bij de bereiding van zepen. De geconcentreerde oplossingen van die basen vinden een toepassing bij het afbijten van verf. • De meest bekende base is Ca(OH)2 (gebluste kalk). Die stof wordt gebruikt bij de bereiding van mortel en plaaster. In de landbouw wordt gebluste kalk toegepast om de bodem minZelf zeep maken met keukenolie en NaOH der zuur te maken. • Al(OH)3 wordt in verven gebruikt als bindmiddel voor organische kleurstoffen en als uitvlokkingsmiddel bij waterzuiverving. • Ammoniak (NH 3 ) komt veel voor in schoonmaakproducten en ontvettingsmiddelen. Het wordt ook toegepast bij de synthese van meststoffen. In industriële koelruimtes wordt ammoniak vaak aangewend als koelmiddel omwille van zijn hoge verdampingswarmte. NH als ontvettingsmiddel Industriële koelruimte 3 20 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 20 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN 1.1.4 Zouten • Definities - karakteristieke groep Een zout kun je theoretisch opvatten als een zuur waarbij de H-atomen volledig (of gedeeltelijk) vervangen zijn door metaalionen of bepaalde positieve groepen (bv. NH1 ). 4 Bij de zouten vind je dus geen karakteristieke groep terug. M en Z staan immers voor een willekeurig metaal- en zuurrest-ion. Alle zouten zijn echter wel ionverbindingen. • Indeling van de zouten Zouten deel je op dezelfde wijze in als de zuren, waarvan ze theoretisch afgeleid kunnen worden: • binaire zouten Mn(nM)m, bv. Na2S • ternaire zouten Mn[(nM)Op]m, bv. Na2SO4; Ca3(PO4)2 • Formule- en naamvorming Copyright Plantyn Algemene formule MnZm De formule kun je makkelijk opstellen als het oxidatiegetal (of de ionlading) van het metaalion (M) én van het zuurrest-ion (Z) gekend is. Voorbeelden Ca2 calciumfosfaat Na1 Ca3(PO4)2 natriumsulfiet PO3 4 Na2SO3 SO2 3 Naamvorming (n) naam van het metaal (of positieve groep) (m) naam van de zuurrest De naam van het zuurrest-ion kan eenvoudig worden afgeleid uit de naam van het overeenkomstige zuur. formule zuur zuurrest naam zuur naam zuurrest-ion H2S S2 waterstofsulfide sulfide-ion HClO2 ClO1 2 waterstofchloriet chloriet-ion H2CO3 CO2 3 waterstofcarbonaat carbonaat-ion De (Griekse) telwoorden n en m hoeven niet noodzakelijk in de naam vermeld te worden, tenzij bij metalen die meerdere oxidatiegetallen kunnen aannemen. Men kan ook het oxidatiegetal van het metaal in de naam opnemen (Stocknotatie). Overzicht : enkele metalen met hun gebruikelijke oxidatiegetallen Cu (I, II) Sn (II, IV) Au (I, III) Zn II Hg (I, II) Pb (II, IV) Fe (II, III) Ag I 1 Verdere kennismaking met stofklassen | 21 OWCH3BW 009-070.indd 21 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Voorbeelden BaF2 bariumdifluoride bariumfluoride CuCl koperchloride koper(I)chloride Cu(ClO3)2 koperdichloraat koper(II)chloraat SnCO3 tincarbonaat tin(II)carbonaat Fe2(SO4)3 di-ijzertrisulfaat ijzer(III)sulfaat (NH4)3PO4 triammoniumfosfaat ammoniumfosfaat AgNO2 zilvernitriet • Enkele gekleurde zouten: PbI2 CuSO4 NiCl2 Eigenschappen van de zouten Zouten zijn ionverbindingen en dus kristallijne, vaste stoffen met meestal een hoog smelt- en kookpunt. • De lading en de straal van beide ionsoorten waaruit het zout is opgebouwd bepalen de oplosbaarheid in water. Tijdens dat oplosproces dissocieert het zout in ionen. • Zouten in vloeibare toestand (de ‘smelt’) en in waterige oplossing geleiden de elektrische stroom. Copyright Plantyn • • Zouten rondom ons • De aardkorst bestaat voor een groot gedeelte uit silicaten (zouten afgeleid van kiezelzuur). Een van de hoofdbestanddelen van klei is aluminiumsilicaat: Al4(SiO4)3. • Kunstmeststoffen bestaan meestal uit nitraat-, sulfaatFluoriden tegen tandbederf en fosfaatverbindingen van kalium, natrium, calcium en ammonium. • In de geneeskunde maakt men gebruik van: – Mg(HCO3)2 en NaHCO3 in poeders en tabletten tegen maagzuur; – BaSO4 als contrastmiddel bij röntgenfoto’s van het maagen darmstelsel; – AlK(S04)2 als bloedstelpend middel; – NaF als een toevoegsel in tandpasta; – (NH4)2CO3 als reukzout. Gipsverband • CaSO4 (gips, CaSO4·2H2O) wordt gebruikt voor gipsverbanden en gipsafdrukken en in pleisterwerk. • Veel zouten van zink, lood en barium komen voor in verven, o.a. ZnSO4 en PbS. De schilders in de middeleeuwen maakten veel gebruik van gekleurde zouten als pigmenten. • NaCl komt in grote hoeveelheden voor in zeewater. Het wordt gebruikt als strooizout, maar bij zeer lage temperatuur gebruikt men ook CaCl2. • Soda (Na2CO3) wordt gebruikt als schoonmaakmiddel, maar is ook een bestanddeel bij de bereiding van glas. • Rijsmiddel in zelfrijzende bloem: NaHCO3, Mg(HCO3)2. 22 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 22 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Omzettingen tussen stofklassen: overzichtsschema van de bereiding en de chemische eigenschappen van anorganische stoffen Het onderstaande schema geeft de samenhang tussen de stofklassen weer. 5 M 5 MZ nM 3 1 6 MO 6 MZ 4 2 MOH HZ komt overeen met H(nM)en H(nM)O (nM)O 7 MZ 7 HZ Reeks A Reeks B Copyright Plantyn Het schema toont hoe stoffen van de verschillende stofklassen in elkaar kunnen omzetten. Je kunt daaruit de bereiding en een aantal eigenschappen van de anorganische stoffen afleiden. Hierna vind je een beknopt overzicht. Reactiepatronen tussen de verschillende anorganische stofklassen Belangrijke reactiepatronen van de anorganische stofklassen 1 2 3 4 5 6 7 metaal + dizuurstof Æ metaaloxide metaaloxide + waterÆ metaalhydroxide niet-metaal + dizuurstof Æ niet-metaaloxide niet-metaaloxide + water Æ zuur metaal + niet-metaal Æ zout metaaloxide + niet-metaaloxide Æ zout hydroxide + zuur Æ zout + water M O2 Æ MO 2 Mg O2 Æ 2 MgO MO H2O Æ MOH Na2O H2O Æ 2 NaOH nM O2 Æ nMO C O2 Æ CO2 nMO H2O Æ HZ SO3 H2O Æ H2SO4 M nM Æ MZ 2 Na Cl2 Æ 2 NaCl MO nMO Æ MZ CaO CO2 Æ CaCO3 MOH HZ Æ MZ H2O Æ Na2SO4 2 H2O 2 NaOH H2SO4 Dit zijn de reactiepatronen die je ook vorig jaar reeds bestudeerd hebt tijdens de studie van de anorganische stofklassen. 1 Verdere kennismaking met stofklassen | 23 OWCH3BW 009-070.indd 23 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Enkele andere belangrijke reactiepatronen zijn: a b metaal + water Æ metaalhydroxide + diwaterstof M H2O Æ MOH 2 Na 2 H2O Æ 2 NaOH H2 metaal + zuur Æ zout + diwaterstof M HZ Æ MZ H2 Mg 2 HCl Æ MgCl2 H2 MO HZ Æ MZ H2O CuO 2 HCl Æ CuCl2 H2O MOH nMO Æ MZ H2O Æ CaSO3 H2O metaaloxide + zuur Æ zout + water c hydroxide + niet-metaaloxide Æ d zout + water e Copyright Plantyn f g Ca(OH)2 SO2 H2 zout(1) + zout(2) Æ zout(3) + zout(4) MZ (1) MZ (2) Æ MZ (3) MZ (4) (zie ionreacties: neerslagvorming) AgNO3 NaCl NaNO3 zuur(1) + zout(2) Æ zout(1) + zuur(2) HZ (1) MZ (2) Æ MZ (1) (zie ionreacties: gasvorming) 2 HNO3 Na2S Æ 2 NaNO3 H2S zout Æ metaal + niet-metaal MZ Æ M nM ontbindingsreactie bij toevoegen van energie ZnI2 Æ Zn I2 Æ AgCl HZ (2) Labo Bereiding en eigenschappen van koolstofdioxide 1 Bereiding van CaCO3 en Ca(HCO3)2, aantonen van CO2 Opstelling Benodigdheden verzadigde oplossing van Ca(OH)2 of Ba(OH)2 eventueel bruiswater Werkwijze Blaas via een rietje voorzichtig in een verzadigde Ca(OH)2- of Ba(OH)2-oplossing. Blijf doorblazen, ook als er reeds een neerslag gevormd is. Eerst wordt een neerslag van CaCO3 gevormd (test op CO2). Ca(OH)2 (opl) CO2 (g) → CaCO3 (v) H2O (vl) Wordt er nog meer CO2 toegevoegd, dan wordt het oplosbare Ca(HCO3)2 gevormd. CaCO3 (v) CO2 (g) H2O (vl) → Ca(HCO3)2 (opl) Alternatief Giet in een verzadigde Ca(OH)2-oplossing een weinig spuitwater (bruisend mineraalwater, CO2-houdend water). Voeg verder spuitwater toe of leid CO2-gas door het mengsel tot de neerslag opgelost is. Verdeel de oplossing over twee recipiënten. Verwarm één recipiënt en bewaar de tweede enkele uren (dagen). Wat neem je waar? 24 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 24 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN 2 Vorming van CO2 Opstelling Benodigdheden Na2CO3, K2CO3, CaCO3 marmer, eierschalen, schelpen ... HCl-oplossing (c 1 mol/l) verzadigde oplossing van Ca(OH)2 Werkwijze Natriumcarbonaat reageert met de zuuroplossing. Noteer die reactie. Ook marmer of calciumcarbonaat reageert met de zuuroplossing. Het bruisen wijst op het ontsnappen van CO2-gas. Dat is een test op carbonaten. Dat het ontsnappende gas CO2 is, kun je aantonen met een Ca(OH)2-oplossing. Herhaal het experiment, maar vervang marmer door een van de volgende stoffen: soda, eierschalen, schelpen, kalkgesteente, grond, maagzout of een waterige oplossing van carbonaten. Copyright Plantyn 3 Zuur-base-eigenschappen Opstelling Benodigdheden Na2CO3, K2CO3, CaCO3 HCl-oplossing (c 1 mol/l) verzadigde oplossing van Ca(OH)2 fenolftaleïne Herhaal het vorige experiment, maar voeg enkele druppels fenolftaleïne toe aan de verzadigde calciumhydroxideoplossing. Als het bruisen stopt, voeg je nog wat carbonaat of zuur toe tot er een kleurverandering optreedt. Welke reactie vindt plaats tussen koolstofdioxide en calciumhydroxide? Vragen 1 Zoek informatie over de vorming van grotten en druipstenen (stalactieten en stalagmieten). 2 Verklaar de onderstaande gegevens (noteer indien mogelijk ook de reactievergelijking). – Bij verwarming van hard water, d.w.z. water dat veel Ca2- en/of Mg2-ionen bevat, ontstaat een neerslag van CaCO3 (ketelsteen). – Die stof wordt meestal afgezet op de wanden van de recipiënt (bv. waterketel) of op het verwarmingselement (bv. elektrische boiler, koffiezetapparaat ...). Bij elektrische apparaten kan het verwarmingselement worden beschadigd door een lokale oververhitting ten gevolge van een slechte warmteoverdracht. – De verwijdering van ketelsteen kan gebeuren met een zwak zuur (bv. azijn). 1 Verdere kennismaking met stofklassen | 25 OWCH3BW 009-070.indd 25 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Oefenen en opzoeken 1 Noteer het totale oxidatiegetal (OGtot) van de onderstaande negatieve atoomgroepen. Nummer 0 1 2 3 4 5 6 7 8 9 Atoomgroep SO3 SO4 CO3 PO4 NO2 PO3 H2PO4 HSO3 HCO3 NO3 OGtot −II Nummer 10 11 12 13 14 15 16 17 18 19 ClO4 HAsO3 OH IO CN ClO3 BrO2 SiO4 AsO4 HPO4 Atoomgroep OGtot 2 Noteer het positieve oxidatiegetal (OG) van de volgende metalen (en de NH4-groep) zoals ze voorkomen in zouten. Je vermeldt twee oxidatiegetallen als er meerdere voorkomen. Copyright Plantyn Nummer 0 1 2 3 4 5 6 7 8 9 Metaal Ca Na Al Ba Pb Fe Cu Hg Sn Li OG +II Nummer 10 11 12 13 14 15 16 17 18 19 Metaal Ag K Mg NH4 Au Zn Co Cd Ni Sr OG 3 Noteer de brutoformule voor elke combinatie van het metaal en de zuurrest. De metalen hebben hun kleinst mogelijke oxidatiegetal (OG). AsO4 Al ClO4 CN Al AsO4 Fe Pb 4 Noteer de brutoformule voor elke combinatie van het metaal en de zuurrest. De metalen hebben hun hoogst mogelijke oxidatiegetal (OG). SO3 PO3 IO3 Au Sn Pb 5 Noteer de formule van de volgende stoffen. Geef, waar mogelijk, ook een vereenvoudigde naam. Naam Formule Vereenvoudigde naam 0 dialuminiumtricarbonaat Al2(CO3)3 aluminiumcarbonaat 1 triwaterstofboraat 2 trikaliumfosfaat 3 dizilversulfaat 4 calciumhydroxide 26 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 26 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN 6 Noteer de formule en een andere systematische naam van de volgende stoffen. Naam Formule Andere naam 0 tin(II)nitraat Sn(NO3)2 tindinitraat 1 ijzer(III)oxide 2 lood(II)oxide 3 koper(I)chloride 4 calciumhydroxide 7 Vervolledig de onderstaande reactievergelijkingen. Copyright Plantyn 0 4K O2 → 1 CaO H3PO4 → 2 HNO3 Mg(OH)2 → 3 Cl2 O2 → 4 Mg Br2 → 5 MgO H2O → 6 LiOH H3BO3 → 7 K H3PO4 → 8 AgNO3 MgI2 → 9 Fe2O3 H2O → 10 Ca(ClO3)2 H2S → 2 K2O max. OG (Cl) 8 Schrijf de gevraagde reacties. 0 de reactie tussen difosfortrioxide en water 1 de verbranding van tetrafosfor 2 calciumhydroxide reageert met koolstofdioxide 3 de reactie tussen soda en fosforzuur 4 de reactie tussen calciumchloride en natriumfosfaat 5 de reactie tussen waterstofnitraat en natriumsulfide P2O3 + 3 H2O → 2 H3PO3 9 Mineralen zijn vaste stoffen van natuurlijke oorsprong met een bepaalde chemische samenstelling en een bepaalde kristalstructuur. Daarom vertonen ze vaak een typisch uitzicht naar kleur en vorm. Bekende mineralen met een relatief eenvoudige chemische samenstelling zijn aluin, apatiet, aragoniet, bauxiet, calciet, cinnaber, dolomiet, gips, haliet, kwarts, limoniet, pyriet, sylviet en vloeispaat. Zoek een voorbeeld van een mineraal dat de onderstaande groep bevat. Geef van dat mineraal de naam, de formule en indien mogelijk de correcte chemische naam. 1 Verdere kennismaking met stofklassen | 27 OWCH3BW 009-070.indd 27 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN groep mineraal formule chemische naam O2 bauxiet Al2O3 aluminiumoxide OH1 S2 SO2 4 PO3 4 Cl1 NO1 3 CO2 3 SiO4 4 Copyright Plantyn 1.2 Stofklassen van de organische chemie (koolstofchemie) 1 Methaan is het belangrijkste bestanddeel van aardgas. 2 Smaakmakers 4 Zeep is een organisch zout. 6 Gekleurde organische stoffen vormen een belangrijk bestanddeel van de huidige verven. 3 Autobanden werden oorspronkelijk gemaakt van natuurlijk rubber. 5 Aspirine: nog altijd een succesrijk geneesmiddel. 7 Naast water bevat melk ongeveer 10 % 8 Aardolie: de basisgrondstof voor veel voedingsrijke organische stoffen. organische stoffen in de industrie. 28 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 28 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Leer de chemie Inleiding De enkele miljoenen koolstofverbindingen die in de natuur voorkomen of synthetisch bereid worden, bestaan uit (reële) moleculen, opgebouwd uit covalent gebonden atomen van een beperkt aantal elementen: C (altijd), H (meestal) en verder heteroatomen als O, N, S, halogenen. Copyright Plantyn De enorme variatie aan koolstofverbindingen is te verklaren door het vermogen van C-atomen om: • open of gesloten, al of niet vertakte ketens te vormen; • met de naburige C-atomen enkelvoudige en/of meervoudige bindingen te vormen; • zich eveneens met heteroatomen als O, N, S, P, halogenen ... te binden. Eerst bestudeer je de monofunctionele stofklassen, d.w.z. stoffen met moleculen waarin slechts één ‘karakteristieke groep’ (ook ‘functionele groep’ genoemd) voorkomt. Van die verbindingen leer je de naamvorming, de fysische en enkele chemische eigenschappen. Nadien maak je kennis met een aantal polyfunctionele organische stoffen. 1.2.1 Algemeen Voorstelling van de koolstofverbindingen: formules en modellen Je kunt verschillende formulevoorstellingen en modellen gebruiken om koolstofverbindingen weer te geven. In principe kies je de eenvoudigste voorstelling die de nodige en voldoende informatie biedt voor de beoogde toepassing. • Formules Brutoformule Voorbeelden: C2H6, C2H4O2, C2H5N, C2HCl3 Deze brutoformules geven geen informatie over de inwendige structuur van de molecule. Elektronenformule Voorbeelden H H C H H O H C C O H H C H Cl N H C H Cl C Cl 1 Verdere kennismaking met stofklassen | 29 OWCH3BW 009-070.indd 29 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Structuurformule Voorbeelden H H O C H C H C O H H C H Cl N C H H H C Cl Cl Door weglating van H-atomen wordt dat soms als volgt vereenvoudigd: Cl O C C C O C N C C Cl H Cl Copyright Plantyn Of vereenvoudigen door bindingsstreepjes te schrappen CH3-COOH CH2CH-NH2 CCl2CHCl of en zelfs en zelfs CH3COOH CH2CHNH2 CCl2CHCl Opmerking Voor grote moleculen en ringstructuren wordt vaak een skeletnotatie gebruikt. Daarin wordt het symbool van koolstof niet weergegeven; enkel de bindingen tussen die atomen. H-atomen worden niet weergegeven, andere heteroatomen wel. Voorbeelden = = = = = 8 8 8 = 8 = CH3-CH2-CH2-CH2-CH2-CH2-COOH = 8 8 = = OH = = Cyclohexaan O Heptaanzuur 30 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 30 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN • Molecuulmodellen Formule H Bolstaafmodel H H C C H H H Bolschilmodel H H C C Cl Cl CH3–CO–CH3 H Copyright Plantyn H H C C C H O H H Indeling van de koolstofverbindingen Men hanteert verschillende criteria. • Het skelet van de molecule a) acyclische koolstofverbindingen (open ketens van opeenvolgende C-atomen, eventueel onderbroken door heteroatomen) C C O C C C C C niet-vertakte keten C C C C C vertakte keten 1 Verdere kennismaking met stofklassen | 31 OWCH3BW 009-070.indd 31 17/06/14 8:04 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN b) cyclische koolstofverbindingen (gesloten ketens) De C-atomen (soms ook samen met heteroatomen) zijn hier in een ringstructuur geschakeld. H H H H C H C C H H C C H C H H H H H H C C H H C C C C H Copyright Plantyn H • Het voorkomen van functionele groepen a) koolwaterstoffen (KWS) CxHy: verbindingen waarvan de moleculen volledig opgebouwd zijn uit koolstof- en waterstofatomen b) monofunctionele verbindingen: verbindingen waarvan de moleculen slechts één en dezelfde functionele groep met een heteroatoom bezitten, waardoor ze tot één bepaalde stofklasse behoren Bv. CH3OH, C3H7OH... alcoholen H COOH, CH3 COOH... carbonzuren c) polyfunctionele verbindingen: verbindingen waarin meerdere (gelijke of verschillende) functionele groepen in de moleculen voorkomen Bv. H2N CH2 COOH aminozuren ... Naamvorming van de koolstofverbindingen De vorming van de systematische naam gebeurt volgens internationaal overeengekomen voorschriften (IUPAC). Vele stoffen worden echter (nog altijd) met hun van oudsher ingeburgerde naam (triviale naam) benoemd. • Voor de vorming van de systematische naam van een koolstofverbinding bepaal en benoem je eerst de basisstructuur (de stam), bv. een koolwaterstofketen, een cyclische structuur. De positie en de naam van de substituenten (atomen of atoomgroepen die als het ware H-atomen vervangen in de stam) voeg je als prefix (voorvoegsel) of als suffix (achtervoegsel) aan de naam van de basisstructuur toe. 32 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 32 17/06/14 8:05 PM Voorbeeld 1. VERDERE KENNISMAKING MET STOFKLASSEN Algemeen Benaming stam pentaan-2- ol C C C C C achtervoegsel substituent O 2-hydroxy-pentaan H voorvoegsel De voorkeur voor de naam gaat naar de naam met het achtervoegsel. Als je bij de keuze van de basisstructuur meerdere mogelijkheden hebt (of als je twijfelt), gebruik je de onderstaande regels. Copyright Plantyn a) De basisstructuur is het skelet met: 1) de meeste meervoudige bindingen; 2) de langste C-keten. b) Je geeft met positietelwoorden de plaats van de meervoudige bindingen en/of de substituenten aan en begint de nummering vanaf het ketenuiteinde dat zich het dichtst bevindt bij: 1) de (belangrijkste) functionele groep zoals weergegeven in het achtervoegsel; 2) een meervoudige binding. c) Je houdt rekening met deze drie zaken: 1) De totale som van de cijfers is zo klein mogelijk; 2) De substituenten worden in alfabetische volgorde vermeld; 3) Gelijke substituenten worden samen vermeld, voorafgegaan door een telwoord (di, tri, tetra ...). Voorbeelden (met vermelding van de nummers van de bovenstaande regels) a1 C C C C C C C C C C en niet C C a2 C C C C C C C en niet C C C C C 1 Verdere kennismaking met stofklassen | 33 OWCH3BW 009-070.indd 33 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN b1 1 2 3 4 C C C C en niet X c1 4 3 2 1 C C C C X 5 4 3 2 1 C C C C C X Y en niet Z 1 2 3 4 5 C C C C C X Y Z (134 235) c2 broom chloor Copyright Plantyn C c3 C C Br Cl en niet chloor broom en niet 1-chloor-3-chloor 1,3-dichloor Cl C C C Cl 1.2.2 Indeling en naamvorming van koolwaterstoffen Naam Algemene formule Voorbeeld Acyclisch verzadigd Alkanen CnH2n2 CH3 CH3 Acyclisch onverzadigd Alkenen Alkynen CnH2n CnH2n2 CH2CH CH3 H C⬅C H Cyclisch Cyclische KWS CnH2n C6H12 CnHn C6H6 (benzeen) 34 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 34 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN • Acyclische verzadigde koolwaterstoffen: alkanen Bij een verzadigde koolwaterstof is het bindingsvermogen van alle aanwezig C-atomen in de molecule maximaal benut. Elk C-atoom is omringd door vier bindingspartners en vormt vier enkelvoudige atoombindingen. A Niet-vertakte ketens C C C C C Algemene brutoformule CnH2nⴙ2 Algemene naam Copyright Plantyn x-AAN x is Grieks telwoord. De eerste vier alkanen (methaan, ethaan, propaan en butaan) benoem je met een semisystematische naam. Vanaf het alkaan met 5 C-atomen gebruik je het Griekse telwoord om de naam te vormen. Overzicht en naamvorming van de niet-vertakte alkanen n-alkaan (R H) aantal C-atomen brutoformule 1 CH4 structuurformule H H C alkylgroep (radicaal R) aggregatietoestand naam brutoformule naam gas methaan CH3 methyl H H 2 C2H6 CH3 CH3 gas ethaan C2H5 ethyl 3 C3H8 CH3 CH2 CH3 gas propaan C3H7 propyl 4 C4H10 CH3 CH2 CH2 CH3 gas butaan C4H9 butyl 5 C5H12 CH3 (CH2)3 CH3 vloeistof pentaan C5H11 pentyl 6 C6H14 CH3 (CH2)4 CH3 vloeistof hexaan C6H13 hexyl 7 C7H16 CH3 (CH2)5 CH3 vloeistof heptaan C7H15 heptyl 8 C8H18 CH3 (CH2)6 CH3 vloeistof octaan C8H17 octyl 9 C9H20 CH3 (CH2)7 CH3 vloeistof nonaan C9H19 nonyl 10 C10H22 CH3 (CH2)8 CH3 vloeistof decaan C10H21 decyl 17 C17H36 CH3 (CH2)15 CH3 vast heptadecaan C17H35 heptadecyl algemeen CnH2n2 alkaan CnH2n1 alkyl 1 Verdere kennismaking met stofklassen | 35 OWCH3BW 009-070.indd 35 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN B Vertakte ketens 2 C 4 C C C C C C R1 R2 Algemene naam x-R1-y-R2-ALKAAN ALKAAN: basisstructuur (stam) x en y: positienummer R1 en R2: alkylgroepen (in alfabetische volgorde) Opmerking De positienummers worden geplaatst onmiddellijk voor het deel van de naam waarop ze betrekking hebben. Copyright Plantyn Voorbeelden H H H CH3 H H H H H C C C C C H C H H H H H H H H H H H C C C C C H H C H H H H H H H H H H H C H C C C C C H H C H H H H H CH CH CH2 CH3 C 2 H 5 H of H H H H H H C C C C C H H H C H H H H H CH3 2-methylpentaan 3-methylpentaan of H CH H CH3 H H H H H H C H H C C C C C H C H H H H H H H 2,3-dimethylpentaan 3-ethyl-2,5-dimethylhexaan methylpropaan 36 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 36 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN dimethylpropaan • Acyclische onverzadigde koolwaterstoffen Bij onverzadigde koolwaterstoffen is het bindingsvermogen van twee of meer C-atomen in de molecule niet maximaal benut. Die C-atomen vormen met elkaar meervoudige bindingen, waardoor ze slechts drie of twee bindingspartners hebben. Types Copyright Plantyn Brutoformule Algemene naam 1 dubbele binding CnH2n alkenen ALK-x-EEN 1 drievoudige binding CnH2nⴚ2 alkynen ALK-x-YN 2 dubbele bindingen CnH2nⴚ2 alkadiënen ALKA-x,y-DIEEN x en y: positienummer voor de meervoudige binding(en) Het positienummer wordt geplaatst onmiddellijk voor het deel van de naam waarop het betrekking heeft. Voorbeelden H H C H H H C H H propeen H H 2 C C C C H H H H H H C but-2-een H H 2 C C C C H C H H H methylbut-2-een H H 1 HC H 4 C CH2 CH C 2H5 CH3 CH 5 CH2 CH3 4-ethyl-5-methylhept-1-yn 1 Verdere kennismaking met stofklassen | 37 OWCH3BW 009-070.indd 37 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Opmerking In de literatuur zul je geregeld nog benamingen lezen als 1-buteen. Dat is een oudere benaming voor but-1-een. Dat soort benamingen wordt nog vrij vaak gebruikt. • Cyclische koolwaterstoffen Types Brutoformule Algemene naam verzadigde koolwaterstoffen CnH2n cycloalkaan onverzadigde koolwaterstoffen CnH2nⴚ2 CnH2nⴚ4 cycloalkeen cycloalkadieen aromatische koolwaterstoffen bv. C6H6 benzeen bv. C6H5CH3 tolueen areen Copyright Plantyn Ook bij de cyclische KWS kunnen meerdere dubbele bindingen voorkomen. Een voorbeeld daarvan zijn de cycloalkadiënen. Een speciale groep binnen die cyclische KWS vormen echter de aromatische KWS (arenen). Daarin wisselen enkelvoudige en dubbele bindingen elkaar af (vorming van een geconjugeerd systeem). De stoffen van die groep bezitten zeer specifieke eigenschappen, die later worden besproken. Voorbeelden H H H H CH3 H C C C C C C H H CH3 H 1,3-dimethylcyclohexaan CH3 H CH3 H H H C H C H C H C 3-methylcyclohexeen C C H H CH3 H CH3 H CH3 CH3 C HC CH HC methylbenzeen tolueen CH C H 38 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 38 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN 1.2.3 Indeling en naamvorming van monofunctionele koolstofverbindingen Bij deze verbindingen komt één karakteristieke groep met heteroatomen voor. Je kunt de verbindingen ruwweg indelen volgens de aanwezige heteroatomen. De karakteristieke groep bevat: een halogeenatoom één of twee zuurstofatomen een stikstofatoom (eventueel in combinatie met zuurstof). • Karakteristieke groep bevat een halogeenatoom Naam Algemene structuurformule Voorbeeld Halogeenalkaan of halogenide R X met X Cl, Br, I, F CH2Cl CHCl2 1,1,2-trichloorethaan Copyright Plantyn • Karakteristieke groep bevat een zuurstofatoom Naam Algemene structuurformule Voorbeeld Alkanol of alcohol R OH CH3 CH2OH ethanol Ether R O R C2H5OC2H5 ethoxyethaan (di-ethylether) O O Aldehyd C C H R H CH3 ethanal O O Keton C C H3C R' R CH3 propanon (aceton) O O Carbonzuur C C R C 3H7 OH OH butaanzuur O O Zout C R O C - CH3 zuurrest-ion O - acetaat-ion O O Ester C R O R' C CH3 O C 3H7 propylethanoaat 1 Verdere kennismaking met stofklassen | 39 OWCH3BW 009-070.indd 39 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN • Karakteristieke groep bevat een stikstofatoom Naam Algemene structuurformule Voorbeeld Amine R NH2 CH3 CH2 NH2 ethaanamine Nitroalkaan R NO2 CH3 CH2 CH2 CH2 NO2 nitrobutaan O O CH3 C Amide R C NH2 NH2 ethaanamide Copyright Plantyn Een overzicht van de stofklassen vind je in de determineertabel achteraan in dit boek (addendum 7). Je kunt die tabel gebruiken om verbindingen onder te brengen in de verschillende stofklassen en ze een naam te geven. Hoe je dat doet, vind je hieronder. De functionele groep van de stofklasse ligt aan de basis van meerdere soorten systematische benamingen. In dit leerboek geven we de voorkeur aan de substitutieve naamvormingsmethode. • Substitutieve naamvorming De molecule wordt opgevat als een alkaan waarbij één H-atoom vervangen is door de functionele groep. Bij de benaming beschouwen we het alkaan als basisstructuur en de functionele groep (met heteroatomen) benoemen we door middel van een typisch voorvoegsel of achtervoegsel. Algemeen: (1) voorvoegsel-ALKAAN (2) ALKAAN-achtervoegsel Indien een positienummer noodzakelijk is, wordt dat geplaatst onmiddellijk voor het deel van de naam waarop het betrekking heeft. • Overzicht van de systematische naamvorming bij de monofunctionele koolstofverbindingen Verbindingsklasse R-functionele groep Substitutieve benaming alkaanachtervoegsel voorvoegselalkaan Halogeenalkaan R X (X Cl, Br, …) Alkanol (alcohol) R OH alkan-ol Amine R NH2 alkaan-amine Alkoxyalkaan (ether) R O-R´ alkoxy-alkaan Nitroalkaan R NO2 nitro-alkaan O Alkanal (aldehyd) C R H halogeen-alkaan amino-alkaan alkan-al (alkaan: R 1 C) 40 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 40 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN O Alkanon (keton) alkan-on (alkaan: R 1 C R´) C R' R O Alkaanzuur (carbonzuur) alkaanzuur (alkaan: R 1 C) C R OH O Ester C R O R' O Amide C R NH2 alkylalkanoaat (alkyl: R´) (alkanoaat: R 1 C) alkaan-amide (alkaan: R 1C) Copyright Plantyn Eenvoudige voorbeelden Formule alkaanachtervoegsel CH3 CH2I Substitutieve benaming voorvoegselalkaan joodethaan CH3 CH2 CH2OH propaan-1-ol CH3 CH2 CH2NH2 propaan-1-amine CH3 O CH2 CH3 methoxyethaan O CH3 C ethanal H O CH3 C CH2 CH3 butanon O CH3 ethaanzuur C OH O H C ethylmethanoaat O CH2 CH3 O CH3 C ethaanamide NH2 1 Verdere kennismaking met stofklassen | 41 OWCH3BW 009-070.indd 41 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Opmerking In de literatuur zul je geregeld nog benamingen lezen als 1-propanol. Dat is een oudere benaming voor propaan-1-ol. Dat soort benamingen wordt nog vrij vaak gebruikt. Copyright Plantyn • Enkele triviale namen Voorbeelden Systematische naam Triviale naam koolwaterstoffen etheen ethyn ethyleen acetyleen (carbuurgas) alcoholen methanol ethanol pentaan-1-ol brandalcohol alcohol, gewone alcohol, wijngeest, spiritus amylalcohol ethers ethoxyethaan (di-ethylether) ether ketonen propanon aceton carbonzuren Bijna elk carbonzuur en zijn zuurrest hebben een eigen triviale naam. Die laatste wordt vaak gebruikt bij de benaming van zouten, esters en aldehyden. Zoals een anorganisch zuur kun je een carbonzuur ook opvatten als een combinatie van een waterstofatoom en een zuurrest (HZ). Bv. HCl HNO3 CH3COOH HCOOH Carbonzuur Zuurrest (Z) Structuurformule Triviale naam Structuurformule Triviale naam HCOOH mierenzuur HCOO1 formiaat CH3COOH azijnzuur CH3COO1 acetaat C2H5COOH propionzuur C2H5COO1 propionaat C3H7COOH boterzuur C3H7COO1 butyraat Opmerking Het woord butyraat is afkomstig van de Latijnse naam voor boter: butyrum. Van dat woord is ook de systematische naam voor een alkaan met vier koolstofatomen afgeleid: butaan. 1.2.4 Isomerie In de koolstofchemie komen vaak verschillende stoffen met eenzelfde brutoformule voor. De moleculen van die verbindingen bevatten dezelfde atomen (gelijke brutoformule), maar hebben een verschillende molecuulstructuur (verschillende structuurformule). Alle stoffen met eenzelfde brutoformule noemen we isomeren. Het verschijnsel noemen we isomerie (Grieks: dezelfde bouwsteentjes). We onderscheiden verschillende soorten isomerie. 42 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 42 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN • Structuurisomerie (constitutie-isomerie) De moleculen van deze isomeren verschillen in structuur – ketenisomerie: een ander koolstofskelet Voorbeelden van ketenisomeren Naam butaan (C4H10) Structuurformule H methylpropaan (C4H10) H Modelvoorstelling H H H H C C C C H H H H H H H C C C H C H H H H H Copyright Plantyn H pentaan (C5H12) methylbutaan (C5H12) H H H H H H H C C C C C H H H H H H H H H C C C C H H C H H H H dimethylpropaan (C5H12) H H H H H C C C H H C H H H C H H H H 1 Verdere kennismaking met stofklassen | 43 OWCH3BW 009-070.indd 43 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Met de brutoformule CH4, C2H6 en C3H8 correspondeert telkens slechts één stof, maar voor C4H10 zijn er al twee mogelijkheden en voor C5H12 zelfs drie. Hoe langer de koolstofketen, des te meer mogelijke ketenisomeren. Het aantal (theoretisch mogelijke) alkaanisomeren met de algemene brutoformule CnH2n2 neemt sterk toe met de waarde van n. n 1, 2, 3 4 5 6 7 8 10 20 30 aantal isomeren 1 2 3 5 9 18 75 366319 4·109 – functie-isomerie: andere functionele groepen Voorbeelden van functie-isomeren Brutoformule C2H6O Structuurformule Copyright Plantyn ethanol H methoxymethaan H H C C H H H H C O Modelvoorstelling H H O H C H H – plaatsisomerie: andere posities van functionele groepen of van meervoudige bindingen Voorbeelden van plaatsisomeren Brutoformule C3H8O Structuurformule propaan-1-ol H propaan-2-ol H H H H C C C H H H H H H C C C H O H Modelvoorstelling O H H H 44 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 44 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN • Stereo-isomerie Deze isomeren verschillen van elkaar doordat bepaalde atomen (of atomengroepen) in hun moleculen andere ruimtelijke posities innemen. De bindingspartners van elk atoom in de moleculen van deze isomeren zijn echter gelijk. – cis-trans-isomerie (geometrische isomerie) Deze isomerie treffen we vooral aan in moleculen waarin een dubbele binding voorkomt en beide dubbelgebonden C-atomen elk nog twee verschillende bindingspartners bezitten. Door de planaire structuur kunnen beide substituenten in dit vlak naast elkaar (cis) of tegenover elkaar (trans) gelegen zijn. Voorbeelden van cis-trans-isomeren Formule CHClCHCl Structuurformule cis-1,2-dichlooretheen H H Copyright Plantyn C trans-1,2-dichlooretheen Modelvoorstelling C Cl Cl H Cl C Cl C H – Optische isomerie (spiegelbeeldisomerie) Deze isomerie komt voor bij chirale moleculen. De chiraliteit in een molecule wordt veroorzaakt door o.a. de aanwezigheid van een asymmetrisch koolstofatoom, d.i. een C-atoom waaraan vier verschillende atomen (groepen) gebonden zijn. Voor een molecule met één asymmetrisch C-atoom zijn twee stereo-isomeren mogelijk die elkaars spiegelbeeld zijn, zoals de linker- en de rechterhand. Vandaar komt de naam chirale moleculen (Grieks: cheir hand). Deze stereo-isomeren worden ook enantiomeren genoemd (Grieks: enantion tegengesteld). Voorbeeld van spiegelbeeldisomerie Stof: alanine Structuurformules 8=( C=' 8 = CH3 8DD= C CH3 COOH NH2 C HOOC H NH2 H Modelvoorstelling 1 Verdere kennismaking met stofklassen | 45 OWCH3BW 009-070.indd 45 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Opmerkingen • In een structuurformule kun je ook een ruimtelijke voorstelling weergeven van de oriëntatie van een bindend elektronenpaar: Vertrekkend vanuit het tekenblad ligt het gebonden atoom meer naar voren. Vertrekkend vanuit het tekenblad ligt het betrokken atoom meer naar achteren. Copyright Plantyn • Spiegelbeeldisomeren hebben ten gevolge van hun analoge bouwpatroon bijna dezelfde fysische en chemische eigenschappen. Wel vertonen ze een verschillende interactie met gepolariseerd licht (zie later). Daarom worden ze ook optische isomeren genoemd en krijgt het verschijnsel de benaming optische isomerie. De verschillende ruimtelijke structuur van optische isomeren is nochtans erg belangrijk in de levende natuur. Daar is vaak slechts een van beide optische isomeren biologisch actief, zodat alleen die isomeer in de natuur voorkomt. Ook bij de productie van vele geneesmiddelen moet men daarmee rekening houden, omdat vaak slechts één optische isomeer het gewenste effect vertoont. asymmetrisch C-atoom aspartaam Spiegelbeeldisomeren: links een molecule met een zoete smaak, rechts een bittere. Een voorbeeld daarvan is de zoetstof aspartaam. Een optisch isomeer is zoet; de andere stof heeft een bittere smaak. 1.2.5 Fysische eigenschappen van koolstofverbindingen • Normaal voorkomen Organische verbindingen hebben, in vergelijking met minerale stoffen, relatief lage kookpunten en zijn dus eerder vluchtige stoffen. De volgende stoffen zijn bij kamertemperatuur gasvormig: – in de verbindingsklasse van de alkanen, alkenen en alkynen de stoffen met 1 tot 4 C-atomen in de molecule; – in de andere verbindingsklassen de stoffen met 1 en 2 C-atomen in de molecule. De alcoholen en de zuren vormen daarop een uitzondering. Alcoholen en zuren met 1 C-atoom zijn al vloeibaar door de aanwezigheid van waterstofbrugkrachten tussen de moleculen. Met de toenemende omvang van de moleculen (stijgende molecuulmassa) evolueert de aggregatietoestand van gas naar vloeistof. De eerste vloeistoffen in elke reeks zijn helder en dun vloeibaar. Naarmate de moleculen omvangrijker worden, wordt de vloeistof meer stroperig en olieachtig. Bij een nog grotere omvang van de moleculen zijn de stoffen vast en kleurloos met een paraffineachtig voorkomen (bij koolwaterstoffen vanaf een ketenlengte met 17 C-atomen, bij alcoholen vanaf 12 C-atomen en bij zuren vanaf 10 C-atomen). • Typische geuren – Koolwaterstoffen, zeker de alkanen, geuren naar benzine. Ze vormen er eveneens een belangrijk bestanddeel van. – Ethers hebben een zeer specifieke geur (bv. diethylether: hospitaalgeur). – Halogeenalkanen bezitten een eigenaardige, wat zoete geur. (bv. chloroform). – Ketonen hebben ook een zeer typische zoete geur (bv. aceton). 46 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 46 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN – De lagere aldehyden (tot 6 C-atomen) bezitten een stekende geur (bv. methanal). - Bij toenemende ketenlengte verkrijgt men olieachtige vloeistoffen met een aangenaam aroma (bloemen, fruit). - Octanal is bijvoorbeeld medeverantwoordelijk voor de geur van sinaasappelen; heptanal levert een bijdrage aan het ‘boeket’ van wijn. – De geur van de lagere alcoholen (tot 3 C-atomen) wordt door velen als aangenaam ervaren. Hogere alcoholen bezitten een minder aangename geur (foezelolie). – Aminen bezitten een walgelijke geur Aroma van wijn (ammoniakachtig, geur van rotte vis). – De lagere carbonzuren (tot 3 C-atomen) vertonen een sterk prikkelende, onaangename geur (bv. azijnzuur). De overige, meer olieachtige zuren ruiken ranzig (zweetgeur, bedorven boter). Copyright Plantyn • Oplosbaarheid Je weet reeds dat een stof oplost in een solvent als de aantrekkingskrachten tussen de verschillende molecuulsoorten (ingebrachte stof en solvent) ongeveer even sterk zijn. – Polaire stoffen zijn meestal oplosbaar in polaire solventen. Omwille van de deelladingen in de moleculen bestaan er aantrekkingskrachten tussen de verschillende moleculen onderling. – Apolaire stoffen zijn vaak oplosbaar in apolaire solventen. – Polaire stoffen zijn slecht oplosbaar in apolaire solventen; apolaire stoffen zijn slecht oplosbaar in polaire solventen. In dergelijke mengsels ontstaan dan meerdere lagen (meerdere fasen). De fase met de grootste massadichtheid vind je onderaan. 1.2.6 Veilige omgang met organische stoffen Het grootste risico van de meeste organische stoffen (beschreven in de zogenaamde H-zinnen: Hazard) ligt in hun brandbaarheid of eventuele giftigheid. Naarmate het kookpunt lager wordt, daalt ook de ontvlammingstemperatuur en neemt het risico toe. De ontwijkende dampen of vloeistoffen kunnen irriterend en schadelijk zijn voor de huid, ogen en ademhalingsorganen. De risico’s in verband met de giftigheid worden vaak weergegeven door drempelwaarden (grenswaarden, MAC-waarden). De vereiste veiligheidsmaatregelen (neergeschreven in de P-zinnen: Precaution) zijn uiteraard afgestemd op de risico’s van de stoffen. Ze hebben vooral betrekking op: • maatregelen tegen brandbaarheid, bv: – de stoffen op een goed geventileerde plaats bewaren; – de stoffen verwijderd houden van ontstekingsbronnen; – niet roken; – oppassen voor ontladingen van statische elektriciteit; • maatregelen tegen giftigheid of schadelijkheid voor het milieu, bv: – de damp niet inademen; – vloeibaar afval niet via de gootsteen en riolering verwijderen. Om het risico op brand te minimaliseren worden de flessen met brandbare vloeistoffen altijd gesloten en ver verwijderd van bunsenbranders of ander vuur. Grote recipiënten (bv. 5 liter) horen zelfs niet thuis in het lab, maar dienen op een veilige plaats te worden opgeborgen. Je zou bij je thuis ook eens kunnen controleren waar brandbare vloeistoffen (methanol, wasbenzine, aceton, verdunner voor verf) worden bewaard! 1 Verdere kennismaking met stofklassen | 47 OWCH3BW 009-070.indd 47 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Om vetvlekken uit kleding te verwijderen (op te lossen) wordt vaak gebruikgemaakt van halogeenalkanen: vroeger het giftige tetrachloormethaan, nu andere stoffen uit dezelfde reeks (weeë geur in stomerijen). Koolwaterstoffen zijn ook in staat om vetten op te lossen, maar die zijn dan weer extreem brandbaar. Naast de zorg voor je eigen veiligheid draag je ook de verantwoordelijkheid voor het milieu. Vloeibare afvalstoffen mag je niet via de riolering lozen of zomaar Veilig werken in een spuitcabine weggieten. (Eén liter afvalolie kan één miljoen liter grondwater ongeschikt maken voor menselijk gebruik!) Vloeibaar organisch afval dien je selectief in te zamelen en op te ruimen via het afvalpark in je gemeente (kga: klein gevaarlijk afval). Maak bij vloeibaar afval zeker een onderscheid tussen zuivere koolwaterstoffen (aardolie, paraffine ...) en chloorhoudende organische stoffen (chloroform, trichloorethaan ...). Labo Copyright Plantyn Geometrie van koolstofverbindingen Opstelling Benodigdheden een set atoommodellen met voldoende C-, H-, O- en Cl-atomen Werkwijze 1 Bouw modellen van onvertakte alkanen met 1, 2, 3, 4 en 5 koolstofatomen. Bouw voor een alkaan met 5 C-atomen de mogelijke isomeren. Noteer van de gebouwde modellen de structuurformule en de naam. 2 Bouw een model van de propaanmolecule. Vervang één H-atoom door een Cl-atoom. Noteer van de gebouwde modellen de structuurformule en de naam. Hoeveel verschillende structuren kun je maken? Noteer van de structuren de structuurformule en de naam. Vervang in de propaanmolecule een H-atoom door een OH-groep. Hoeveel isomeren zijn hier mogelijk? Geef naam en structuurformule. 3 Bouw een molecuulmodel van een propeenmolecule. Zijn hier isomeren mogelijk? Is er nog een vrije rotatiemogelijkheid tussen de C-atomen? Vervang hier twee H-atomen door twee Cl-atomen. Hoeveel isomeren zijn er mogelijk? Noteer de structuurformule en de naam. Bekom je een cis-trans-isomeer? 4 Bouw een molecuulmodel van mierenzuur. Vervang een H-atoom door een CH3-groep. Welke isomeren vind je? Noteer naam, structuurformule en de verbindingsklasse. 48 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 48 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Oefenen en opzoeken 1 Noteer de structuurformule van de onderstaande verbindingen. 0 2-methylpropaan-1-ol CH3 CH CH2 O H Copyright Plantyn CH3 1 1, 2-dichloorprop-1-een 2 butoxypentaan 3 3-methylpentaanzuur 4 3-methylbutanal 5 3-chloor-2-methylbutaan-1-ol 2 Er worden telkens twee isomeren gegeven. Geef de systematische naam van beide stoffen. Vermeld eveneens welk soort isomerie er voorkomt en verklaar je antwoord. Structuurformule Naam Soort isomerie 1-chloorbutaan plaatsisomerie 2-chloorbutaan De substituent staat op een ander C-atoom 0 1 2 1 Verdere kennismaking met stofklassen | 49 OWCH3BW 009-070.indd 49 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN 3 4 Copyright Plantyn 3 Geef de juiste systematische naam en ook de triviale naam van de onderstaande verbindingen. 0 HCOOH methaanzuur 1 (C2H5)2O 2 CHCl3 3 H2CO 4 (CH3)2CO 5 CH3COOH mierenzuur 4 Duid in deze structuurformule drie verschillende functionele groepen aan en benoem ze. H H H H H O C C C C C H H H O H O H C H C O H 5 De lagere esters hebben vaak een zoete, fruitachtige geur. Ze komen in de natuur voor in vruchten als de aardbei, de abrikoos, de ananas, de appel, de sinaasappel, de banaan, de druif, de framboos, de kers, de limoen, de peer ... Ze worden ook gebruikt als geurstof of smaakstof. Zoek enkele voorbeelden van die esters. Noteer de structuurformule, de systematische naam en eventueel de triviale naam. Vind je ook een omschrijving van de geur en van een toepassing? 50 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 50 17/06/14 8:05 PM Structuurformule Geur en gebruik 1. VERDERE KENNISMAKING MET STOFKLASSEN Namen Copyright Plantyn 1.3 Polyfunctionele organische stoffen 1 Mottenballen 4 Plastic 6 Suiker 2 Verven van textiel 3 Aangebrand vlees: gevaar voor PAC’s 5 Olijfolie 7 Eiwit 8 DNA in chromosomen 1 Verdere kennismaking met stofklassen | 51 OWCH3BW 009-070.indd 51 17/06/14 8:05 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Leer de chemie 1.3.1 Indeling van de polyfunctionele organische stoffen Polyfunctionele organische stoffen bevatten moleculen met meerdere gelijke of verschillende karakteristieke groepen. De moleculen hebben dus een basisstructuur (bv. een open of een cyclische koolwaterstof) waarvan meerdere H-atomen vervangen zijn door substituenten (gelijke of verschillende functionele groepen). A B A KWS KWS A A A Voorbeelden: O HO-CH2-CH-CH2-OH H 2 N-CH 2-CH 2 -OH CH 3-CH C OH Copyright Plantyn B KWS NH 2 OH De naamvorming van polyfunctionele verbindingen is analoog met die van monofunctionele koolstofverbindingen. Naast de systematische benaming volgens de IUPAC-voorschriften wordt, zeker voor verbindingen met een ingewikkelde structuur, overvloedig en vaak haast uitsluitend gebruikgemaakt van de van oudsher ingeburgerde triviale benaming, zoals glucose, alanine en linolzuur. Enkele voorbeelden Zoek een overeenkomst tussen de gegeven naam en de gegeven structuurformule. De naam tussen haakjes is een veelgebruikte triviale benaming. CH2OH CHOH CH2OH propaan-1,2,3-triol (glycerol) 8=( C=' 8 2-aminopropaanzuur (alanine) 8DD= = HOOC COOH ethaandizuur (oxaalzuur) D= =DD8 8=' 8 8=' 8DD= 2-hydroxy-propaan-1,2,3-tricarbonzuur (citroenzuur) 8DD= De verdere indeling van polyfunctionele organische stoffen in allerlei stofklassen is geen eenvoudige zaak, omdat die samenhangt met de belangrijkheid en eigenschappen van de aanwezige karakteristieke groepen. Wij beperken ons hier tot de groep van de biomoleculen. 1.3.2 Biochemische stoffen Biochemische stoffen komen voor in de levende cellen en zijn meestal polyfunctionele organische stoffen. Zij vervullen een belangrijke rol in de biochemische processen die zich afspelen in de levende 52 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 52 17/06/14 8:06 PM • 1. VERDERE KENNISMAKING MET STOFKLASSEN organismen. De moleculen van deze stoffen, biomoleculen genoemd, zijn daarenboven dikwijls macromoleculen opgebouwd uit een groot aantal kleinere biomoleculen. Belangrijke biomoleculen zijn lipiden, koolhydraten, proteïnen en nucleïnezuren. Lipiden (vetten, oliën) Lipiden vormen een zeer diverse groep van biochemische stoffen die alle onoplosbaar zijn in water, maar goed oplossen in organische solventen zoals ether. In je leefwereld ken je uit die groep voornamelijk de oliën en de vetten. Je treft ze aan als reservestoffen bij planten en dieren. Het zijn complexe mengsels van tri-esters (of triglyceriden), afgeleid van glycerol (propaan-1,2,3-triol) en carbonzuren. De hogere carbonzuren worden in de voedingschemie meestal met de naam vetzuren aangeduid. algemene formule Copyright Plantyn vetzuurrest voorbeeld g l y c e r o l O vetzuurrest of O CH2 O C O R1 CH2 O C O CH2 (CH2) 15 - CH3 CH O C O R2 CH O C O CH2 (CH2) 13- CH3 CH2 O C R3 CH2 O C CH2 (CH2) 5 - CH3 vetzuurrest De vetzuurrestgroepen (R) bevatten altijd een oneven aantal koolstofatomen (meestal 11 tot 19). De ketens kunnen zowel verzadigd als onverzadigd zijn. Voorbeelden van vetzuren Verzadigd/ Aantal Compacte structuurformule onverzadigd Catomen Ts (°C) Naam verzadigd 4 CH3—(CH2)2—COOH 8 butaanzuur (boterzuur) 16 CH3—(CH2)14—COOH 63 hexadecaanzuur (palmitinezuur) 18 CH3—(CH2)16—COOH 69 octadecaanzuur (stearinezuur) 1x 16 onverzadigd CH3—(CH2)5—CHCH—(CH2)7—COOH 0,5 hexadec-9-eenzuur (palmitoleïnezuur) 18 CH3—(CH2)7—CHCH—(CH2)7—COOH 13,5 octadec-9-eenzuur (oliezuur) 2x 18 onverzadigd CH3—(CH2)4—(CHCH—CH2)2—(CH2)6—COOH 5 3 x onverzadigd CH3—(CH2—CHCH)3—(CH2)7—COOH 18 octadeca-9,12dieenzuur (linolzuur) 12 octadeca-9,12,15trieenzuur (linoleenzuur) Vetten zijn bij kamertemperatuur eerder vaste of alleszins zeer stroperige stoffen; ze bevatten vooral verzadigde vetzuurresten. 1 Verdere kennismaking met stofklassen | 53 OWCH3BW 009-070.indd 53 17/06/14 8:06 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Oliën daarentegen zijn vloeibaar. Ze bevatten vooral onverzadigde vetzuurresten. Linoleenzuur wordt in de voedingschemie vaak een omega-3-zuur genoemd omdat men de plaats van de dubbele binding bepaalt vanaf het ketenuiteinde. • Sachariden Sachariden (gluciden, koolhydraten, suikers) zijn belangrijke bestanddelen van levende organismen. Ze leveren zowel energie als bouwmateriaal voor vele organismen. De algemene formule van de sachariden kan worden geschreven als Cn(H2O)m. Vandaar de oude benaming koolhydraten. Die naam wordt nog altijd vaak gebruikt. Sacharide is afgeleid van het Latijnse woord saccharum (suiker). De naam sachariden is een verzamelnaam voor allerlei poly-hydroxy-aldehyden of polyhydroxy-ketonen of derivaten daarvan. H CH2OH O Copyright Plantyn C H C OH HO C H H C OH H C OH C O HO C H H C OH H C OH CH2OH CH2OH glucose: een poly-hydroxy-aldehyd fructose: een poly-hydroxy-keton D stoffen ff komen k h meestall voor in een gesloten l d ) Deze echter ringstructuur ((zie verder). Sachariden worden bijna altijd benoemd met hun triviale namen, omdat de systematische namen te ingewikkeld zijn voor alledaags gebruik. Zo zijn glucose, fructose en sacharose stoffen die je goed kent. Sachariden worden meestal naar stijgende complexiteit ingedeeld in drie groepen: monosachariden, disachariden en polysachariden. Het zijn vooral de mono- en disachariden die een zoete smaak hebben en die je beter kent onder de naam suikers. Enkele veelvoorkomende sachariden: Monosachariden Glucose C6H12O6 Deze stof wordt gevormd tijdens de fotosynthese bij groene planten. Ze wordt aangetroffen in appels, druiven en honing en ook als bloedsuiker bij mens en dier. Fructose Dit vind je in vruchten, tomaten en honing. Disachariden zijn opgebouwd uit twee monosacharide-eenheden. De molecuulformule is C12H22O11 Sacharose Deze stof komt voor in suikerbieten en suikerriet en in onze alledaagse keukensuiker. 54 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 54 17/06/14 8:06 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Maltose Deze stof, moutsuiker, wordt gebruikt bij het bierbrouwen. Polysachariden zijn opgebouwd uit vele monosacharide-eenheden. Zetmeel Zetmeel is een belangrijke reservestof voor planten. Glycogeen Deze stof is een belangrijke reservestof voor mens en dier. Cellulose Cellulose vormt de basisvezel van hout. Cellulose is ook de grondstof voor de bereiding van plantaardige textielmaterialen (bv. katoen), papier, cellofaan ... Omdat de binding tussen de monomeren anders is dan bij zetmeel en glycogeen, kunnen wij, mensen, geen cellulose gebruiken als voedsel. CH2OH Glucose O H H OH H H OH OH Copyright Plantyn HO Fructose H H OH O CH2OH OH CH2OH H OH Sacharose CH2OH H O OH H HO O H H OH OH H O H Zetmeel CH2OH H H H2COH OH H2COH CH2OH H2COH H2COH H2COH H2COH maltose - eenheid 1 Verdere kennismaking met stofklassen | 55 OWCH3BW 009-070.indd 55 17/06/14 8:06 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN • Proteïnen (eiwitten) Proteïnen (eiwitten) zijn zeer belangrijke verbindingen in elk levend organisme. Zij spelen een belangrijke rol in de structuur van talrijke weefsels zoals spieren, huid, haar ... (vezelproteïnen), maar ze zijn ook functioneel als enzym of biokatalysator, hormoon, transportmiddel en antilichaam. Proteïnen zijn stoffen met lange ketenvormige biopolymeren (polypeptideketens), ontstaan door aaneenschakeling van aminozuurmoleculen en met een specifieke en unieke ruimtelijke structuur. Aminozuren en de peptidebinding Voorbeelden van belangrijke aminozuren Aminozuur Afkorting glycine Gly Structuurformule NH2 CH COOH H alanine Ala NH2 CH COOH Copyright Plantyn CH3 asparaginezuur Asp NH2 CH COOH CH2 COOH cysteïne Cys NH2 CH COOH CH2 SH lysine Lys NH2 CH COOH CH2 CH2 CH2 CH2 NH2 Deze aminozuren bevatten een COOH-groep en een NH2-groep op hetzelfde C-atoom. Door de reactie van de NH2-groep van één aminozuur met de COOH-groep van een ander aminozuur ontstaat een peptidebinding. peptidebinding H H H2N C R1 CO OH + H NH C R2 COOH H 2N H O C C R1 H NH C COOH + H2O R2 Een aaneenschakeling van talrijke aminozuren noem je een polypeptideketen. 56 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 56 17/06/14 8:06 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Structuur van de proteïnen Deze situeert zich op verschillende niveaus. De samenstelling van de polypeptideketen en de opeenvolging van de aminozuren erin noemen we de primaire structuur van een proteïne. Primaire structuur Cys bv. insuline S Val S Glu Phe Val Glu Val Cys Phe Asp S S Leu Tyr Gly Ser His Leu Leu 2 Copyright Plantyn Ser S His Leu Cys Asp Cys Ala Asp Leu Glu Tyr Glu Tyr Val Gly Ala Gly Phe Arg Val Cys Tyr Gly S Gly Leu Glu Cys 1 Ser Leu Glu Thr Pro Lys Ala De twee peptideketens (1 en 2) zijn ter hoogte van de cysteinebouwstenen door zwavelbruggen verknoopt. Deze polypeptideketens nemen bepaalde ruimtelijke structuren aan zoals een vouwblad- of een helixstructuur en noem je de secundaire structuur van de proteïne. Bij veel proteïnen zijn de polypeptideketens, met fragmenten vouwblad- en/of helixstructuur, opgerold tot een bolvormig geheel, gestabiliseerd door de vorming van waterstofbruggen of andere bindingen. Dat bolvormige geheel is de tertiaire structuur van de proteïne. Het is belangrijk voor zijn biochemische activiteit. Sommige proteïnen, zoals hemoglobine, dat zuurstof bindt in bloed, zijn pas biologisch actief wanneer verschillende proteïne-eenheden onderling samenbinden tot één groter geheel: men spreekt dan van een proteïne bestaande uit subeenheden. Die associatie noemt men de quaternaire structuur. • Nucleïnezuren De moleculen van de nucleïnezuren dragen de genetische informatie van levende wezens en kunnen die informatie ook doorgeven. Het zijn ketenvormige macromoleculen die, zoals de eiwitten, ook verschillende zeer complexe ruimtelijke structuren kunnen aannemen. In de biologie onderscheidt men twee soorten nucleïnezuren: - deoxyribonucleïnezuren (DNA): dat zijn de dragers van het genetisch materiaal in de celkern; - ribonucleïnezuren (RNA): die brengen de genetische informatie over van de celkern naar het cytoplasma en helpen bij de vertaling van de informatie om eiwitten op te bouwen. Nucleïnezuren zijn opgebouwd uit honderden tot duizenden eenheden: de nucleotiden. Elk nucleotide bevat structuurelementen afkomstig van: – een suiker (een ribose-vijfring), – een cyclisch polyamine, – fosforzuur (waterstoffosfaat). 1 Verdere kennismaking met stofklassen | 57 OWCH3BW 009-070.indd 57 17/06/14 8:06 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Voorbeeld van een nucleïnezuurfragment Probeer de drie karakteristieke atomengroepen van elk nucleotide te onderscheiden. NH2 N -CH2 O N P A OH S P S A C NH2 G P C P N O N P P C C C S S P S 1 nm S P T S A G S P T OH O N O N O OH O N NH N NH2 O O – P – O – CH2 OH S P S P S S C T P T S P C G A P S P S 0,34 nm S S S P S S C P G S A G P G G S Polynucleotideketen Elke nucleotide is opgebouwd uit deoxyribose + fosfaat + nucleïnebase. P P O O – P – O – CH2 A S T P S G P NH O – P – O – CH2 S C S 3,4 nm O P C P CH3 O S S S nucleoside O S G S Copyright Plantyn T P O nucleotide S P N O – P – O – CH2 S P N S P C S P P Ruimtelijke structuur van DNA (dubbele helix) 58 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 58 17/06/14 8:06 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN SAMENVATTING Het belangrijkste onthouden! Stofklassen van de anorganische of minerale chemie • Oxiden – Metaaloxiden zijn ionverbindingen van metaalionen (Mn) met oxide-ionen (O2). De aanwezigheid van oxide-ionen is karakteristiek voor deze stoffen. Algemene formule Naamvorming MnOm (n) naam van het metaal (m) oxide Niet-metaaloxiden zijn atoomverbindingen van niet-metaalatomen en zuurstofatomen. Een of meerdere covalent gebonden zuurstofatomen zijn karakteristiek voor deze verbindingen. Algemene formule Copyright Plantyn Naamvorming (nM)nOm (n) naam van het niet-metaal (m) oxide • Zuren – Arrhenius (1887) Zuren zijn stoffen die in water ioniseren en daarbij H1ⴙ-ionen vormen. – Brønsted (1923) Zuren zijn stoffen die zich gedragen als protondonor’(H1ⴙ-afgifte). – Karakteristieke groep Zowel de Arrhenius- als de Brønsted-definitie van een zuur is gebaseerd op de afsplitsing van H1 en de vorming van een negatief zuurrest-ion. De karakteristieke groep in een zuurmolecule is een gepolariseerde H-(nM)-binding waaruit een H1-ion kan worden vrijgemaakt. – Algemene formule HnZ (Z zuurrest) Hn(nM): Hn(nM)Op: binair zuur ternair zuur – Naamvorming: zie tabel p. 17 • Basen – Arrhenius (1887) Basen zijn stoffen die in water dissociëren in ionen: er worden altijd hydroxide-ionen (OH1ⴚ) vrijgezet. – Brønsted (1923) Basen zijn stoffen waarvan de deeltjes zich gedragen als protonacceptor (H1ⴙ-opname). – Karakteristieke groep Volgens de Arrhenius-definitie is het OH1–-ion, dat vrijkomt bij de dissociatie van de base in water, typisch voor een base en dus voor de karakteristieke groep. Karakteristiek voor een Brønsted-base is dat het basedeeltje ten minste één vrij elektronenpaar heeft om een proton (H1) te binden. Enkel opgelost in water vormt de Brønsted-base OH1–-ionen. 1 Verdere kennismaking met stofklassen | 59 OWCH3BW 009-070.indd 59 17/06/14 8:06 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN – Algemene formule – Naamvorming M(OH)n metaal (n) hydroxide Als het metaal slechts één oxidatiegetal kan aannemen, kun je ook slechts één correcte formule schrijven en worden de indices meestal niet vermeld. – Sommige metalen vertonen echter meerdere oxidatiegetallen. In die verbindingen moet je het oxidatiegetal of de nodige indices in de naam vermelden. • Zouten Alle zouten zijn ionverbindingen. M en Z staan voor een willekeurig metaal- en zuurrest-ion. Bij de zouten tref je dus geen karakteristieke groep aan. – Algemene formule – Naamvorming MnZm Copyright Plantyn (n) naam van het metaal (of positieve groep) (m) naam van de zuurrest De (Griekse) telwoorden hoef je niet noodzakelijk in de naam te vermelden, tenzij bij metalen die meerdere oxidatiegetallen kunnen aannemen. Je kunt ook het oxidatiegetal in de naam opnemen (Stocknotatie). Reactiepatronen tussen anorganische stofklassen: zie tabel en overzicht p. 23-24 Stofklassen van de organische of koolstofchemie • • Koolwaterstoffen Monofunctionele koolstofverbindingen Een overzicht van de verschillende stofklassen en hun karakteristieke groep vind je terug op p. 40-41. Zie ook addendum 7: determineertabel. De basis van de naamgeving is de naam van de langste koolwaterstofketen: alkaan. De karakteristieke groep bepaalt de stofklasse. De naam van de stof wordt gegeven door een typisch voor- of achtervoegsel. • voorvoegsel-ALKAAN bv. trichloormethaan • ALKAAN-achtervoegsel bv. propaan-2-ol Een brutoformule geeft meestal te weinig informatie over de aard van de stof. In de koolstofchemie is bijna altijd een structuurformule vereist. Isomeren Stoffen met dezelfde brutoformule, maar met een verschillende structuur, zijn isomeren van elkaar. Er bestaan: • structuurisomeren • ketenisomeren: de isomeren hebben een verschillend C-skelet • functie-isomeren: de isomeren bevatten verschillende karakteristieke groepen • plaatsisomeren: bij de isomeren staat de substituent op een verschillend C-atoom 60 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 60 17/06/14 8:06 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN • stereo-isomeren De substituenten staan op dezelfde C-atomen (of hetzelfde C-atoom), maar ze zijn ruimtelijk anders geplaatst: • cis-trans-isomeren: door de aanwezigheid van een dubbele binding • optische isomeren: door de aanwezigheid van een asymmetrisch C-atoom Copyright Plantyn Polyfunctionele organische stoffen De moleculen van deze groep, die vaak in de natuur voorkomen, bezitten meerdere karakteristieke groepen. • Biochemische stoffen – Lipiden: tot deze groep behoren de oliën en vetten. Deze stoffen zijn esters van glycerol (propaan-1,2,3-triol) en vetzuren. – Sachariden: een oudere naam is koolhydraten. We onderscheiden: - monosachariden: kleinste sacharide-eenheid, meestal voorkomend in een ringstructuur, bv. glucose en fructose; - disachariden: twee gekoppelde monosacharide-eenheden (ringen), bv. sacharose, de gewone suiker; - polysachariden: vele aan elkaar gekoppelde sacharide-eenheden. Voorbeelden zijn zetmeel en glycogeen (voeding) en cellulose (celwand van planten). – Proteïnen (eiwitten): een aaneenschakeling van aminozuren. Eiwitten vormen de basis van het leven. – DNA en RNA: deze stoffen zijn de dragers van de genetische informatie van planten, dieren en mensen. Ze zijn opgebouwd uit ketens nucleotiden. Elk nucleotide bevat structuurelementen afkomstig van een ribosesuiker, een fosfaatgroep en een base. De opeenvolging van de basen is bepalend voor de genetische informatie. 1 Verdere kennismaking met stofklassen | 61 OWCH3BW 009-070.indd 61 17/06/14 8:06 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Copyright Plantyn Belangrijke begrippen alkanen alkenen alkynen asymmetrisch C-atoom basisstructuur biomoleculen biopolymeer functionele groep hydroxide isomeer structuurketenfunctieplaatsstereocis-transoptischkarakteristieke groep koolstofketen koolstofverbindingen monofunctionele verbindingen polyfunctionele verbindingen koolwaterstof acyclisch cyclisch koolwaterstof koolwaterstof niet-vertakte keten vertakte keten verzadigd onverzadigd oxiden skeletstructuur stofklassen structuurformule substitutieve naamvorming zouten zuren en basen volgens Arrhenius zuren en basen volgens Brønsted 62 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 62 17/06/14 8:06 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN s r e p p a h c Belangrijike wetens Copyright Plantyn Fundamentele bijdragen aan het systeem van chemische stofklassen en de chemische nomenclatuur werden geleverd door: Classificatie en naamgeving anorganische stoffen Antoine Laurent Lavoisier, 1743–1794 Frans chemicus Lavoisier formuleerde als eerste de wet van behoud van massa voor een chemische reactie. Hij toonde aan dat de verbranding een proces is waarbij een stof reageert met dizuurstof. Hij liet water ontbinden in waterstofgas en zuurstofgas. Tevens legde hij de basis voor de indeling van de anorganische stofklassen en voor de naamgeving van anorganische stoffen. Hij gaf definities voor zuren, basen en zouten. Hij bestudeerde ook de alcoholische gisting en bewees dat diamanten uit koolstof bestaan. Zijn bekendste werk, meteen ook de grondslag van de moderne chemie, is het boek Traité élémentaire de chimie. Classificaties, naamgeving en formules van stoffen Joris Jacob Berzelius, 1779–1848 Zweeds chemicus Berzelius was de grondlegger van het moderne chemisch tekenschrift en van de chemische nomenclatuur. Hij ontdekte of isoleerde een groot aantal enkelvoudige stoffen: cerium (Ce), seleen (Se), lithium (Li), thorium (Th), tantaal (Ta), silicium (Si), zirkonium (Zr) en bepaalde eveneens de atoommassa van een aantal atoomsoorten. Hij beschreef de begrippen organische chemie, isomerie, katalyse en isoleerde diverse organische stoffen uit natuurproducten. Zijn Leerboek van de chemie in zes delen (1808–1830) was lange tijd de bijbel van de 19de-eeuwse chemie. Organische stofklassen en voedingsstoffen Justus von Liebig, 1803–1873 Duits chemicus Von Liebig is de grondlegger van de landbouwchemie en van de elementenanalyse (onderzoek van de procentuele samenstelling van de atoomsoorten in een stof). Hij wordt beschouwd als de uitvinder van de kunstmest en van de industriële voedselproductie (o.a. Liebig-blokjes met vleesextracten). Hij legde ook het verband tussen de zure eigenschappen van een stof en de aanwezigheid van waterstofatomen. Zuren en basen Svante Arrhenius, 1859–1927 Zweeds chemicus Arrhenius legde de grondslag voor de elektrolytische dissociatie van stoffen in water en voor de reacties tussen ionen in water. Daarvoor kreeg hij in 1903 de Nobelprijs voor de Scheikunde. Hij beschreef de rol van protonen en hydroxide-ionen in zuurbasereacties. Hij deed ook onderzoek naar de reactiesnelheid van chemische processen. Naast zijn chemisch onderzoek leverde hij ook belangrijke bijdragen tot het klimaatonderzoek en tot de studie van meteorieten. 1 Verdere kennismaking met stofklassen | 63 OWCH3BW 009-070.indd 63 17/06/14 8:06 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Copyright Plantyn Zuren en basen Johannes Nicolaus Brønsted, 1879–1947 Deens fysicochemicus Brønsted stelde een model op voor de reactie tussen zuren en basen gebaseerd op overdracht van protonen (H1). Hij was ook bekend voor zijn werk op het vlak van de katalyse van reacties. Vierwaardigheid van C August Kekulé, 1829–1896 Duits chemicus Kekulé ontdekte dat koolstofatomen in organische moleculen altijd vier bindingen vormen met omringende atomen en dat daardoor ketenvormige stoffen kunnen ontstaan. Hij realiseerde ook een doorbraak in de zoektocht naar de structuur van benzeen, het basismolecule van de aromatische chemie. Hij stelde benzeen voor als een koolstofzesring met afwisselend enkelvoudige en dubbele bindingen. Hij was hoogleraar aan de universiteit van Gent van 1858 tot 1867. Tetraëdermodel van koolstof Jacobus van 't Hoff, 1852–1911 Nederlands chemicus Van 't Hoff kreeg de eerste Nobelprijs voor de Scheikunde voor zijn onderzoek in de thermodynamica (energieaspecten) van chemische reacties. Hij leverde ook belangrijk werk rond het verschijnsel van de osmose. Zijn onderzoek van de isomerie van halogeenalkanen leidde tot de ontdekking van een van de grondslagen van de stereochemie: het tetraëdermodel van koolstof. Dat is de oriëntatie van de enkelvoudige bindingen rond een koolstofatoom volgens de hoekpunten van een tetraëder. IUPAC Deze internationale organisatie waakt onder meer over de chemische nomenclatuur en symboliek. Ze erkent en benoemt nieuw ontdekte atoomsoorten en controleert en corrigeert de getalwaarden en symbolen van eenheden en grootheden in de chemie. IUPAC werd in 1919 gesticht door België, Italië, Frankrijk, GrootBrittannië en de Verenigde Staten. 64 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 64 17/06/14 8:06 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Leestekst 1 Copyright Plantyn Keukenzout: smaakverbeteraar, maar nog veel meer ... Het zout dat we op ons eitje strooien of het snuifje dat we toevoegen bij de bereiding van groenten of sausjes noemen we consumptiezout. Dat keukenzout is slechts een zeer kleine fractie van de hoeveelheid natriumchloride (NaCl) die door de chemische industrie wordt verwerkt. Keukenzout is een van de weinige grondstoffen waarvan we tot in de eeuwigheid genoeg zullen hebben. Zeewater bevat 30 g natriumchloride per liter, wat overeenkomt met 19 g chloor. We vinden Na1- en Cl1 -ionen van nature ook in ons bloed, in onze voeding en drank, kortom overal. De wereldzeeën bevatten ongeveer 26.1015 ton chloor. Als we de zee zouden droogdampen, dan bleef op de bodem een 75 m dikke laag zeezout achter, die voor het grootste deel uit keukenzout (natriumchloride, NaCl) zou bestaan. Reeds in het steentijdperk werd zout als voedseltoevoeging gebruikt. Dat het altijd een waardevol artikel gebleven is, blijkt uit het feit dat de Romeinse soldaten een gedeelte van hun wedde (salaris) uitbetaald kregen in zout (sal). Massa’s zout worden gebruikt als bewaarmiddel, als likstof voor rundvee, als basis voor fysiologische oplossingen in de geneeskunde, als strooizout tegen ijzelvorming en in waterverzachters. De grootste hoeveelheid gaat echter naar de chemische industrie, waar het als basisgrondstof dient voor de bereiding van het metaal natrium en chloorgas en alle verbindingen (vooral chloorhoudende verbindingen) die daarvan zijn afgeleid. 1 Verdere kennismaking met stofklassen | 65 OWCH3BW 009-070.indd 65 17/06/14 8:06 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Natriumchloride als conserveermiddel in de voeding “Zout wordt nooit aangevreten door de wormen.” (Saoedi-Arabisch spreekwoord) Copyright Plantyn Het bewaren van voedsel door toevoeging van chemische stoffen is een techniek die van oudsher werd toegepast en die tot het cultuurpatrimonium van een volk gerekend kan worden. Het pekelen van vlees en vis, het opleggen in suikersiroop of in azijn, het bewaren van eieren in waterglas: het zijn allemaal technieken die bederf tegengaan, vaak ten koste van de eigen smaak van de voedingsmiddelen. In bepaalde gevallen is die smaakverandering echter gewild en levert de bewaringsmethode nieuwe voedingsproducten (bv. zuurkool, yoghurt, kaas). Het bewaren door toevoegen van zout (pekel), suiker (siroop) of alcohol berust op het binden van het aanwezige water. Daardoor wordt zowel de microbiële als de biochemische activiteit sterk verminderd, maar niet volledig uitgeschakeld. De methodes bieden dus geen garantie tegen bederf. Het toevoegen van azijnzuur (azijn) heeft een pH-verandering tot gevolg: beneden pH 4,5 kunnen de eiwitafbrekende verrottingsbacteriën niet meer groeien. Andere chemische additieven zijn in zulke lage concentraties werkzaam dat ze smaak noch geur beïnvloeden. Het gebruik van additieven is streng gereglementeerd: alle toevoegsels zijn verboden, tenzij die welke voorkomen op een positieve lijst. Criteria waaraan additieven moeten beantwoorden: Voldoende actief zijn in relatief lage concentratie; Niet giftig zijn voor de gebruiker (zowel acuut als op lange termijn); Inert zijn ten opzichte van de andere bestanddelen of van de verpakking; Chemisch, fysisch en microbiologisch stabiel zijn; Smaakloos, reukloos en kleurloos zijn, tenzij deze eigenschappen gewenst zijn; Economisch aanvaardbaar zijn. Het gebruik is via de nationale wetgeving (B-lijst) en internationale verdragen (E-lijst) geregeld. Er werden ook een maximale dosis en eventuele beperkingen in gebruik vastgelegd. Conserveermiddelen vinden we terug in drie groepen: conserveermiddelen (E200-E299): tegen microbieel bederf, antioxidanten (E300-E399): tegen chemisch bederf, emulgatoren, stabilisatoren en geleermiddelen (E400-E499): tegen fysisch bederf. Hieronder vind je, naast natriumchloride, nog enkele andere veelgebruikte additieven: Benzoëzuur (benzeencarbonzuur) (E210) Natriumnitriet (E250) Sorbinezuur (trans, trans-2,4-hexadieenzuur E200) en zouten Zwaveldioxide en sulfieten (E220) L-Ascorbinezuur (vitamine C: E300) Butylhydroxyanisol (E320) en butylhydroxytolueen (E321) Citroenzuur (E330) 66 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 66 17/06/14 8:06 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Natriumchloride: een historisch belangrijke grondstof voor de prille chemische industrie Het gebruik van natriumchloride in de chemische industrie dateert al uit de 18de eeuw. Er was immers behoefte aan soda, natronloog en chloorgas. Glasmakers hadden naast silica (SiO2) en ongebluste kalk (CaO) ook soda (natriumcarbonaat, Na2CO3) nodig om glas (Na2O·CaO·6SiO2) te maken. Silica en ongebluste kalk haalde men uit zand en kalksteen (CaCO3), beide in overvloed beschikbaar in de natuur. Copyright Plantyn Zeepmakers hadden behoefte aan natronloog (NaOH) om uit dierlijke oliën of plantaardige vetten zepen te maken. Zij verkozen natronloog boven gebluste kalk (Ca(OH)2). Het laatste was ruim voorhanden, maar vormt zepen die slecht oplossen in water. De Zweedse chemicus Carl Wilhelm Scheele bereidde in 1774 voor het eerst chloorgas (Cl2) uit zoutzuur (HCl) en bruinsteen (MnO2). Scheele realiseerde zich niet dat het groengele gas dat hij geproduceerd had een enkelvoudige stof was. Pas in 1811 identificeerde Sir Humphry Davy het gas als een chemisch element. Hij noemde het chloor, afgeleid van het Griekse woord chloros, dat groen betekent. Berthollet en Saussure hadden inmiddels de blekende werking van het ‘nieuwe gas’ ontdekt (1786). Maar die onderzoekers bemerkten ook de nadelen van het bleekmiddel: bij ongecontroleerd gebruik werden de katoenen en linnen vezels aangetast door het gas, het was niet handzaam in gebruik en het was moeilijk te transporteren. De behoefte aan chloor steeg pas toen de Schotse chemicus Charles Tennant bleekpoeder ontdekte (1799), dat hij bereidde uit gebluste kalk (Ca(OH)2) en chloorgas. De textielindustrie, die tot dan toe het zonlicht gebruikte om katoen en linnen te bleken, had grote behoefte aan een sneller werkend middel. Bleekpoeder voldeed aan die behoefte. Bij het oplossen in water ontstaat hypochloriet (ClO1); het daaruit vrijkomende O2 veroorzaakt uiteindelijk de blekende werking. In de 18de en 19de eeuw waren er de eerste industriële processen om op grote schaal soda en natronloog te bereiden uit natriumchloride. Uit het zoutzuur (HCI), dat daarbij als bijproduct ontstond, maakte men chloorgas en bleekpoeder. Het nadeel van de processen was dat er (te) veel nutteloze bijproducten werden gevormd. Eind 19de eeuw (1890) werd een heel nieuw proces ontwikkeld: de elektrolyse van een natriumchlorideoplossing. Door een elektrische stroom door de zoutoplossing (‘pekel’) te leiden, ontstaan respectievelijk chloorgas en natronloog aan beide elektroden. Daarnaast wordt als enig bijproduct waterstofgas gevormd, dat talrijke toepassingen heeft in de chemische industrie. 1 Verdere kennismaking met stofklassen | 67 OWCH3BW 009-070.indd 67 17/06/14 8:06 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Oplossen van natriumchloride in water NaCl(v) → Na1ⴙ ⴙ Cl1ⴚ (dissociatie in water) Elektrolyse van de zoutoplossing Kathode (ⴚ) : 2 H2O ⴙ 2 eⴚ → 2OH1ⴚ ⴙ H2 (Na1ⴙ ⴙ OH1ⴚ → NaOH) Anode (ⴙ) : 2 Cl1ⴚ → Cl2 ⴙ 2 eⴚ Copyright Plantyn Het gevormde chloorgas is matig oplosbaar in water. Daardoor ontstaat de mogelijkheid dat er een reactie optreedt met het natriumhydroxide, waardoor er natriumhypochloriet (NaClO) gevormd wordt, het actieve bleekmiddel in ‘javelwater’. 2 NaOH Cl2 -→ NaClO NaCl H2O Wil men die reactie voorkomen, dan moet men werken met gescheiden elektroderuimtes, zodat het chloorgas niet in aanraking komt met het gevormde natriumhydroxide. Ook moet men ervoor zorgen dat het chloorgas gescheiden blijft van het aan de kathode vrijkomende waterstofgas. Mengsels van beide gassen zijn namelijk buitengewoon explosief (chloorknalgas!) en reageren tot HCl-gas. Aanvankelijk was in de chemische industrie de elektrolyse van een NaCl-oplossing vooral belangrijk voor de productie van loog (NaOH-oplossing), onder meer gebruikt in de zeepfabricage. Chloorgas was daarbij een beperkt bruikbaar bijproduct. Pas in de jaren zestig kreeg de behoefte aan chloor de bovenhand. Sinds kort echter lijkt de situatie weer om te keren en zal de industrie bij een beperking van de chloorproductie onder meer een ander type loogfabrieken moeten bouwen. Nog enkele toepassingen van koolstofchloorverbindingen chloormethaan of methylchloride: CH3Cl – gebruikt bij de synthese van bijvoorbeeld siliconen en butylrubber 68 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 68 17/06/14 8:07 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN dichloormethaan of methyleenchloride: CH2Cl2 – oplosmiddel voor verf en gebruikt bij de synthese van cellulosetriacetaat (filmen, vezels) Copyright Plantyn trichloormethaan of chloroform: CHCl3 – oplosmiddel en extractiemiddel, gebruikt bij de synthese van bijvoorbeeld teflon – vroeger ook gebruikt als verdovingsmiddel in de geneeskunde bij operaties tetrachloormethaan of tetra: CCl4 – een van de giftigste chlooralkanen – onder meer gebruikt bij de synthese van freonen, de chloorfluorkoolwaterstoffen (cfk); vanwege de ozonproblematiek als drijfgas vervangen door vooral butaan – vaak ingezet als ontvettingsmiddel, zowel voor huishoudelijk als voor professioneel gebruik; vandaag verboden vanwege zijn giftigheid trichlooretheen: CHCICCl2 en tetrachlooretheen: CCl2CCl2 – reinigingsmiddel in stomerij en voor het ontvetten van metalen – 35 % gaat naar de bereiding van vinylchloride (chlooretheen, CH2CHCl), het basisproduct voor de bereiding van de kunststof polyvinylchloride (pvc). polyvinylchloride: ~(CH2–CHCl)n~ – Is na polyetheen de meest gebruikte kunststof. – Is vooral bekend als verpakkingsmateriaal: de flessen kunnen worden herkend aan de lasnaad in de bodem. – Kent nog ontelbare andere toepassingen: zachte pvc vindt men terug in plastic mapjes, vloertegels, bloedzakjes, kunstlederen handtassen en tuinslangen; harde pvc wordt gebruikt voor de productie van deuren, raamkozijnen en afvoerbuizen. – De jaarproductie in West-Europa bedraagt ongeveer 5 000 ton. Belgische bedrijven zijn belangrijke producenten en verwerkers en zorgen voor heel wat tewerkstelling. Nagenoeg 80 % van de pvc-productie wordt geëxporteerd. Terwijl chloor in de chemische industrie razend populair is vanwege de vele toepassingen, is er ook een keerzijde aan de medaille: chloor en diverse chloorproducten kunnen schadelijke gevolgen hebben voor mens en milieu. Denken we maar aan de problemen ontstaan door het gebruik van het insecticide DDT en cfk’s (chloorfluorkoolwaterstoffen, drijfgassen in spuitbussen) en bij de vorming van giftige dioxines in verbrandingsovens. Vele van die cfk’s zijn nu verboden wegens de aantasting van de beschermende ozonlaag in de aardatmosfeer. Het zijn deze, door de mens gemaakte, giftige en meestal zeer stabiele organische chloorverbindingen die voor milieuoverlast zorgen en die regelmatig door milieubewegingen worden aangeklaagd. Sommige milieubewegingen pleiten onomwonden voor een ‘chemie zonder chloor’ en stellen concrete alternatieven voor. 1 Verdere kennismaking met stofklassen | 69 OWCH3BW 009-070.indd 69 17/06/14 8:07 PM 1. VERDERE KENNISMAKING MET STOFKLASSEN Copyright Plantyn Een van de zondebokken is de kunststof polyvinylchloride (pvc). Voordelen ervan zijn o.a. de lage kostprijs, het geringe energieverbruik bij de productie, de beperkte uitstoot van CO2 bij de verbranding en de grote afzetmarkt van gerecycleerde pvc in de bouwnijverheid. De milieuproblemen situeren zich voornamelijk bij de productie en de afvalverwerking: aan de productie komen gevaarlijke gassen zoals dichloor en vinylchloride te pas, terwijl bij bepaalde bereidingsmethoden van chloorgas kwik in het milieu kan vrijkomen. Bij de eventuele verbranding in de vuilverbrandingsovens komt waterstofchloride (HCl) vrij (medeverantwoordelijk voor zure regen) en kunnen schadelijke, dioxines worden gevormd. De discussies die vaak tussen industrie en milieubewegingen gevoerd worden over de pro’s en de contra’s van chloor worden niet altijd met wetenschappelijke argumenten gestaafd en zijn vaak eerder gevoelsmatig van aard. Feit is dat chloor een natuurlijk voorkomend element is en dat chloorverbindingen chemisch even normaal zijn als verbindingen met zuurstof en waterstof. Zo bestaat het menselijk lichaam voor 0,1 % uit chloor. De grote bekommernis moet zijn, en dat geldt ook voor niet-chloorverbindingen, om bij nieuwe producten naast de kosten-batenanalyse ook een milieuanalyse op te maken, zodat voor- en nadelen afgewogen kunnen worden, en zo tot een verantwoord gebruik van deze verbindingen te komen. Om over na te denken of om op te zoeken • Bestudeer hoe het gehalte aan NaCl op voedseletiketten wordt aangeduid. • Hoe kun je het gehalte aan Na1ⴙ omrekenen naar een aantal gram NaCl? • Zoek de chemische formules van enkele in de tekst vermelde veelgebruikte voedseladditieven. Tot welke verbindingsklassen behoren ze? • Ga op de verpakking van enkele voedingsmiddelen na welke conserveermiddelen ze bevatten. • Dichloor kan worden aangetoond met een KI-zetmeelpapiertje. In aanwezigheid van dichloor worden de jodide-ionen geoxideerd tot vrij dijood (I2 ). Noteer de chemische reactievergelijking. Welke aggregatietoestand en welke kleur heeft vrij dijood? Zoek een veelgebruikte identificatiereactie voor dijood, die ook toepassingen kent in de voedingschemie. • In het ziekenhuis worden aan patiënten ‘baxters’ toegediend, via een infuus in bijvoorbeeld een ader van de onderarm. Dergelijke baxters bevatten dikwijls een oplossing van NaCl, die isotonisch is met bloedserum. Wat betekent isotonisch? De deeltjesconcentratie van bloedserum bedraagt 0,325 mol/l. Als je één liter oplossing in water maakt met daarin 9,5 gram NaCl, dan krijg je een isotonische oplossing met bloedserum. Controleer dat met een berekening. • Surf naar de onderstaande websites. Misschien vind je er nog andere in verband met ‘keukenzout’? http://www.zout.be/ http://www.belgochlor.be/ 70 | 1 Verdere kennismaking met stofklassen OWCH3BW 009-070.indd 70 17/06/14 8:07 PM